Содержание
Резюме
Сердечно-сосудистые заболевания (ССЗ) являются одной из основных причин смерти среди взрослого населения во всем мире, в т. ч. и в Российской Федерации. При этом лидирующую позицию в структуре причин смерти от ССЗ занимает ишемическая болезнь сердца (ИБС): 16% от общего числа смертей в мире в год. В новых клинических рекомендациях Министерства здравоохранения РФ 2020 г. по ведению пациентов со стабильной ИБС обозначены две основные цели консервативной терапии: устранение симптомов заболевания и профилактика сердечно- сосудистых осложнений (ССО). В связи с этим при выборе антиангинальной терапии у пациентов со стабильной стенокардией необходимо рассматривать возможность применения комбинаций препаратов как первой, так и второй линии с целью реального повышения эффективности лечения и достижения поставленных целей. Целесообразно и оправдано более широкое применение препаратов второй линии, в частности триметазидина на любом этапе терапии для усиления антиангинальной эффективности β-адреноблокаторов, антагонистов кальция и нитратов пролонгированного действия, особенно у пациентов с особенностями гемодинамики (артериальной гипотонией, нарушением ритма и проводимости), что продемонстрировано в приведенном клиническом примере. Дополнение треметазидина к арсеналу традиционных антиангинальных препаратов эффективно применяется в практической деятельности и имеет отражение в новых клинических рекомендациях Министерства здравоохранения РФ 2020 г. Накопленный опыт использования триметазидина позволяет патогенетически обоснованно подходить к терапии стабильной ИБС, восстанавливая баланс между потребностью в кислороде и его доставкой к сердечной мышце, а профиль безопасности расширяет возможности применения у пациентов с коморбидной патологией.
Ключевые слова: ишемическая болезнь сердца, стабильная стенокардия, антиангинальная терапия, антиангинальные препараты, триметазидин.
Для цитирования: Борисова Е.В., Остроумова О.Д., Переверзев А.П., Павлеева Е.Е. Выбор стратегии антиангинальной терапии у пациентов со стабильной ишемической болезнью сердца в реальной клинической практике: преимущества триметазидина. Медицинский совет. 2021;(12):25–32. https://doi.org/10.21518/2079-701X-2021-12-25-32.
Борисова Екатерина Викторовна, к.м.н., врач-кардиолог, Городская клиническая больница имени Е.О.
Мухина; 111399, Россия, Москва, Федеративный проспект, д. 17; ekaterina-vikt@mail.ru
Остроумова Ольга Дмитриевна, д.м.н., профессор, заведующий кафедрой терапии и полиморбидной
патологии,
Российская медицинская академия непрерывного профессионального образования; 125993, Россия, Москва, ул. Баррикадная,
д.
2/1, стр. 1; профессор кафедры клинической фармакологии и пропедевтики внутренних болезней, Первый Московский
государственный медицинский университет имени
И.М. Сеченова (Сеченовский Университет); 119991, Россия, Москва, ул. Трубецкая, д. 8, стр. 2;
ostroumova.olga@mail.ru
Переверзев Антон Павлович, к.м.н., доцент кафедры терапии и полиморбидной патологии, Российская
медицинская академия непрерывного профессионального образования; 125993, Россия, Москва, ул. Баррикадная, д. 2/1, стр.
1; acchirurg@mail.ru
Павлеева Елена Евгеньевна, к.м.н., ассистент кафедры пропедевтики внутренних болезней и
гастроэнтерологии, Московский государственный медико- стоматологический университет имени А.И. Евдокимова; 127473,
Россия, Москва, ул. Делегатская, д. 20, стр. 1; pavleeva.elena@mail.ru
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Введение
По данным Всемирной организации здравоохранения (ВОЗ) сердечно-с осудистые заболевания (ССЗ) являются одной из основных причин смерти среди взрослого населения во всем мире, в т. ч. и в Российской Федерации. При этом лидирующую позицию в структуре причин смерти от ССЗ занимает ишемическая болезнь сердца (ИБС): 16% от общего числа смертей в мире в год. В настоящее время ежегодная смертность от ИБС среди населения Российской Федерации составляет 27% [1]. Несмотря на успехи в лечебно-п рофилактических мероприятиях, больные с установленным диагнозом стабильной стенокардии умирают от ИБС в 2 раза чаще, чем лица без этого заболевания [2]. В связи с этим в рекомендациях Европейского кардиологического общества по диагностике и лечению хронических коронарных синдромов (2019) целью ведения данной категории пациентов определено не только уменьшение симптомов заболевания, но и улучшение прогноза, направленного на снижение рисков повторных сердечно- сосудистых событий и смертности с помощью соответствующих лекарственных средств и медицинских вмешательств, а также с помощью контроля факторов риска, включая образ жизни [3]. Стабильная ИБС может иметь сравнительно доброкачественное течение на протяжении многих лет, и лишь постепенное прогрессирование атеросклероза коронарных артерий и сердечной недостаточности приводит к снижению функциональной активности больных, а также к острым сердечно- сосудистым осложнениям, в т. ч. фатальным [2, 4–6].
Снижение функциональной активности пациентов со стабильной ИБС отражает снижение качества их жизни. Клинические проявления в виде ангинозных приступов, болей в грудной клетке являются маркерами низкой толерантности к физической нагрузке и приводят к снижению работоспособности, подвижности, самообслуживания, повседневной активности, влияют на уровень благополучия и удовлетворенности различными сторонами жизни у данной категории пациентов, что может приводить к эмоциональным расстройствам, вплоть до тревожных и депрессивных состояний [7]. В новых клинических рекомендациях Министерства здравоохранения РФ по ведению пациентов со стабильной ИБС (2020) обозначены две основные цели консервативной терапии: 1) устранение симптомов заболевания, что приводит к повышению качества жизни, 2) профилактика сердечно- сосудистых осложнений (ССО), что приводит к увеличению продолжительности жизни и снижению инвалидизации пациентов [2]. Использование данной концепции в практической деятельности обеспечивает благоприятное течение заболевания, снижает количество осложнений, потребность в хирургических вмешательствах и повторных госпитализациях.
В основе консервативного лечения стабильной ИБС лежит не только комплексная медикаментозная терапия, но и устранение модифицируемых факторов риска ССО, таких как избыточная масса тела, курение, артериальная гипертензия, сахарный диабет, дислипопротеидемия, а также информирование пациентов о наличии у них ИБС, о характере ее течения, факторах риска и выбранной стратегии терапии [2, 8].
На старте антиангинальной терапии пациентам со стабильной ИБС патогенетически обосновано назначение как минимум одного препарата для устранения стенокардии / ишемии миокарда с целью восстановление баланса между потребностью и доставкой кислорода к сердечной мышце и улучшения качества жизни [2, 3]. В качестве антиангинального препарата первой линии пациентам со стабильной стенокардией I–II функционального класса (ФК) и частотой сердечных сокращений (ЧСС) > 60 уд./мин рекомендуется назначение β-адреноблокатора или недигидропиридинового блокатора медленных кальциевых каналов для снижения ЧСС до значений 55–60 уд./мин. В случае стабильной стенокардии более высокого (III–IV) ФК оптимально назначение комбинации β-адреноблокатора с дигидропиридиновыми блокаторами медленных кальциевых каналов для достижения меньшего ФК и уменьшения симптомов проявления заболевания. Оценку эффективности назначенной терапии целесообразно проводить в ближайшее время (через 3–5 дней) и через 2–4 нед. после старта лечения. При недостаточной эффективности препаратов 1-й линии рекомендуется добавить к лечению один из препаратов 2-й линии: органические нитраты или ивабрадин (у пациентов с синусовым ритмом, фракцией выброса (ФВ) ≤ 35% и ЧСС покоя > 70 уд./мин при сохранении стенокардии, несмотря на прием антиангинальных препаратов 1-й линии или при ЧСС > 80 уд./мин, и синусовом ритме при наличии противопоказаний к назначению β-адреноблокаторов или недигидропиридинового блокатора медленных кальциевых каналов), или триметазидин, ранолазин или никорандил – в зависимости от уровня артериального давления (АД), ЧСС и переносимости с целью профилактики приступов стенокардии и достижения I ФК [2, 3].
Не стоит забывать о наличии сопутствующих заболеваний и состояний, таких как сахарный диабет, почечная и печеночная недостаточность, пожилой возраст пациента, нормальное и (или) пониженное АД, которые требуют индивидуального подхода к стратегии антиангинальной терапии. Кроме того, лечение стабильной ИБС должно быть направлено на профилактику ССО, риск которых у пациентов с ИБС очень высокий, и включает в себя антиагрегантную и гиполипидемическую терапию.
Однако в клинической практике очень часто возникают ситуации, которые диктуют необходимость коррекции стандартной схемы антиангинальной терапии. В связи с этим приводим следующий клинический пример.
Клинический пример
Пациент Х., 59 лет. Жалобы на момент обращения на средней интенсивности давящие боли за грудиной без иррадиации при ходьбе в быстром темпе, подъеме по лестнице на 3-й этаж, эмоциональном перенапряжении, купирующиеся в покое в течение 5 мин.
Анамнез заболевания. Ранее повышение АД отрицает, привычное АД 120/80 мм рт. ст. Около года отмечает типичные ангинозные боли при интенсивной физической активности, купирующиеся в покое в течение нескольких минут. Наблюдался у кардиолога по месту жительства. Рекомендованные лекарственные препараты (название не уточняет, не помнит) принимал нерегулярно, однако эпизодически, со слов пациента, курсами использовал β-адреноблокатор бисопролол в дозе 5 мг. В течение последних двух месяцев лекарственные препараты не принимает. Ухудшение самочувствия отметил примерно около месяца назад, когда появились вышеописанные давящие боли за грудиной. При самостоятельном измерении АД составляло около 120/80 мм рт. ст., пульс – 65–70 уд./мин.
Анамнез жизни. Перенесенные заболевания: в детском возрасте – корь, в зрелом возрасте – хронический гастрит. Операции отрицает. Женат, имеет взрослую дочь. Аллергологический анамнез не отягощен. В настоящее время не курит около двух лет, ранее стаж курения около 10 лет по 10 сигарет в сутки (индекс курящего человека – 5 пачка/лет); алкоголем, со слов пациента, не злоупотребляет. Профессиональные вредности отрицает, работает водителем. Наследственность: мать страдала ИБС, умерла от инфаркта миокарда в возрасте 60 лет.
При объективном осмотре: состояние удовлетворительное. Рост 160 см, вес 57 кг. Индекс массы тела – 22,3 кг/см2, окружность талии – 88 см. Кожные покровы обычной окраски, чистые. Отеков нет. Пульс 65 уд./мин., ритмичный. АД сидя 120/80 мм рт. ст. Границы относительной сердечной тупости не расширены. Частота дыханий – 16 в мин. Над всей поверхностью легких ясный легочный звук. Дыхание везикулярное, хрипов нет. SpO2 – 99%. Живот при пальпации мягкий, безболезненный. Размеры печени по Курлову 9 х 8 х 7 см. Симптом поколачивания отрицательный с обеих сторон.
Результаты лабораторных и инструментальных методов обследования. Клинический анализ крови и общий анализ мочи: без отклонений от нормальных значений. Биохимический анализ крови: креатинин – 94 мкмоль/л, глюкоза натощак – 4,5 ммоль/л, общий холестерин – 4,0 ммоль/л, триглицериды – 0,6 ммоль/л, липопротеины низкой плотности – 2,0 ммоль/л, липопротеины высокой плотности – 1,2 ммоль/л, натрий – 140 ммоль/л, калий – 4,5 ммоль/л.
Электрокардиограмма: синусовый ритм, 66 уд./мин, нормальное положение электрической оси сердца.
Эхокардиография: аорта – стенки уплотнены, диаметр корня 2,7 см; левое предсердие – 3,2 см, объем – 34 мл; правое предсердие, объем – 33 мл. Левый желудочек (ЛЖ): конечно- диастолический размер – 4,4 см, конечно- диастолический объем – 90 мл, конечно-с истолический объем – 27 мл, ударный объем – 63 мл, фракция выброса ЛЖ – 70%. Толщина межжелудочковой перегородки (ТМЖП) – 0,9 см, толщина задней стенки (ТЗС) ЛЖ – 0,7 см, индекс массы миокарда ЛЖ (иММЛЖ) – 70,7 г/м2, индекс относительной толщины (ИОТ) – 0,32. Нарушений локальной сократимости не выявлено. Переднезадний размер правого желудочка – 2,1 см. Митральный клапан – створки уплотнены, движение в противофазе, митральная регургитация 1-й ст., трехстворчатый клапан – регургитация 1-й ст. Диастолическая функция ЛЖ не нарушена. Признаков легочной гипертензии не выявлено (систолическое давление в легочной артерии 18 мм рт. ст.)
Стресс-ЭКГ (велоэргометрия), протокол BRUCE: субмаксимальное число сердечных сокращений 75% – 116 в мин, 85% – 132 в мин. Исходная частота ритма – 66 уд./мин. Исходное АД – 122/78 мм рт. ст. Максимальная мощность нагрузки (METs) – 7,8. Продолжительность нагрузки – 7 мин 03 с. Максимально выполненная нагрузка – 10,1 METs (129%), на высоте нагрузки ЧСС – 137 в мин. АД при максимальной нагрузке – 143/80 мм рт. ст.
Состояние больного во время нагрузки: на высоте нагрузки жалобы на чувство дискомфорта за грудиной без иррадиации. ЭКГ во время нагрузки: на высоте нагрузки в V3–V6 косовосходящая депрессия ST максимально до 1,3 мм, нарушения ритма и проводимости не зарегистрированы. Восстановительный период – 11 мин 05 с, АД – 126/78 мм рт. ст., ЧСС – 86 уд./мин. Жалобы самостоятельно купировались. Заключение: проба сомнительная. Толерантность к нагрузке высокая. Реакция АД по нормотоническому типу. Нарушения ритма и проводимости не зарегистрированы (рис. 1).
Рисунок 1. Результат стресс- ЭКГ (велоэргометрии) пациента Х., 59 лет, до лечения
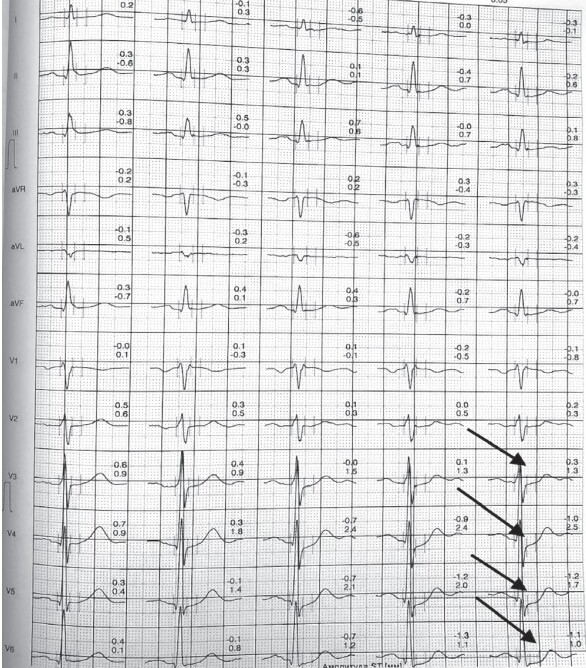
Примечание. Стрелками показана косовосходящая депрессия ST в V3–V6 (максимально до 1,3 мм) на высоте нагрузки.
С учетом данных жалоб, анамнеза, объективного осмотра, данных лабораторно- инструментальных методов исследования пациенту выставлен диагноз: «ИБС: стенокардия напряжения II ФК».
Пациенту в качестве антиангинальной терапии был назначен препарат первой линии β-адреноблокатор бисопролол в дозе 5 мг 1 р/сут утром. Кроме того, с целью профилактики ССО инициирована антиагрегантная терапия ацетилсалициловой кислотой в кишечнорастворимой форме в дозе 100 мг 1 р/сут вечером и ингибиторами ГМГ-КоА-редуктазы аторвастатином в дозе 40 мг.
При контрольном визите через 2 нед. на регулярной терапии пациент отмечает положительную динамику: типичные ангинозные боли не рецидивировали, толерантность к физической нагрузке увеличилась, однако стал отмечать некоторое снижение работоспособности. При объективном осмотре зарегистрировано АД сидя 110/60 мм рт. ст., частота пульса 50 уд./мин, ритмичный. В связи с этим принято решение об уменьшении дозы β-адреноблокатора бисопролола до 2,5 мг 1 р/сут утром и усилении терапии препаратом 2-й линии – назначен триметазидин с пролонгированным освобождением в дозе 70 мг 1 р/сут утром (Депренорм® ОД 70 мг, ЗАО «Канонфарма Продакшн», Россия). Данное решение было основано на показателях гемодинамики пациента. С учетом склонности к гипотонии применение препаратов первой линии в качестве комбинации, а именно дигидропиридиновых блокаторов медленных кальциевых каналов, не предоставлялось возможным, так же как и препаратов второй линии – органических нитратов пролонгированного действия, которые значимо снижают системное АД. Кроме того, учитывая склонность пациента к брадикардии, применение ивабрадина также нецелесообразно, учитывая его выраженное ритмурежающее действие.
При втором контрольной визите пациент отмечает хорошее самочувствие, ангинозные боли не рецидивируют, переносимость физической нагрузки удовлетворительная, работоспособность полностью восстановлена и сохранена. АД при измерении во время визита 120/75 мм рт. ст., ЧСС – 60 уд./мин. При проведении ЭКГ и эхокардиографии диагностически значимых изменений в исследуемых параметрах не выявлено. При стресс-Э КГ (велоэргометрии) в динамике, протокол BRUCE: субмаксимальное число сердечных сокращений 75% – 116 в мин, 85% – 132 в мин. Исходная частота ритма – 68 уд./мин. Исходное АД 128/70 мм рт. ст. Максимальная мощность нагрузки (METs) – 7,8. Продолжительность нагрузки – 7 мин 20 с. Максимально выполненная нагрузка – 10,2 METs (130%), на высоте нагрузки ЧСС – 145 в мин. АД при максимальной нагрузке – 146/80 мм рт. ст. Состояние пациента во время нагрузки: жалобы не предъявлял. ЭКГ во время нагрузки: на высоте нагрузки в V3–V6 косовосходящая депрессия ST максимально до 0,3 мм, нарушения ритма и проводимости не зарегистрированы. Восстановительный период – 7 мин 05 с, АД – 128/82 мм рт. ст., ЧСС – 72 уд./мин. Жалоб нет. Заключение: проба отрицательная. Толерантность к нагрузке высокая. Реакция АД по нормотоничекому типу. Нарушения ритма и проводимости не зарегистрированы (рис. 2).
Рисунок 2. Результат стресс- ЭКГ (велоэргометрии) пациента Х., 59 лет, на фоне терапии бисопрололом 2,5 мг 1 р/сут утром и триметазидином (Депренорм ОД 70 мг) 1 р/сут утром
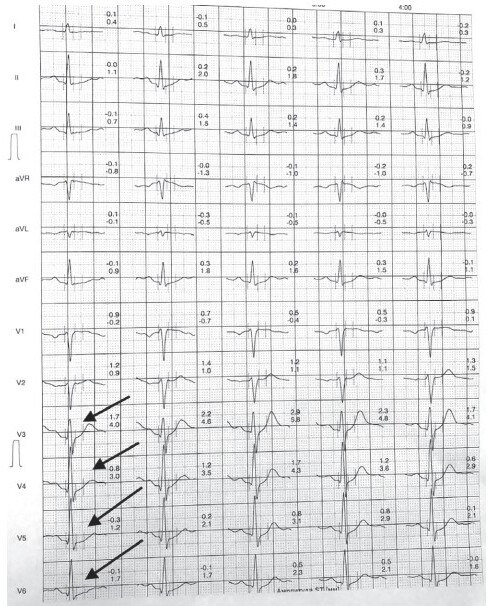
Примечание. Стрелками показана косовосходящая депрессия ST в V3–V6 (максимально до 0,3 мм) на высоте нагрузки (положительная динамика по сравнению с результатами исходной стресс- ЭхоКГ). Заключение: проба отрицательная.
С учетом увеличения толерантности к физической нагрузке, эффективной профилактики приступов стенокардии, улучшения результатов инструментальных исследований, хорошей переносимости терапии пациенту было рекомендовано продолжить прием указанной комбинации антиангинальной терапии с повторением эхокардиографии и стресс-Э КГ через 3 мес. В биохимическом анализе крови липопротеины низкой плотности – 1,38 ммоль/л.
Таким образом, в описанном выше клиническом примере благодаря применению препарата триметазидин в составе комбинированной антиангинальной терапии с целью усиления эффективности препарата 1-й линии бисопролола продемонстрировано достижение основных целей лечения стабильной ИБС, а именно: устранение симптомов стенокардии и снижение риска ССО, увеличение толерантности к физической нагрузке и улучшение качества жизни пациента. Полученный результат согласуется с рядом литературных данных, которые подтверждают эффективность и безопасность применения триметазидина у пациентов со стабильной стенокардией.
Обсуждение
Триметазидин является селективным ингибитором фермента 3-кетоацил- коэнзим- А-тиолазы в клеточных митохондриях и переключает метаболизм миоцитов с окисления длинноцепочечных жирных кислот на усиление окисления глюкозы и ускорение гликолиза с окислением глюкозы, предотвращает снижение внутриклеточной концентрации аденозинтрифосфата (АТФ) и обеспечивает нормальное функционирование мембранных ионных каналов, трансмембранный перенос ионов калия и натрия, что способствует защите миокарда от ишемии и сохранению энергоресурса клеток в состоянии гипоксии [9, 10]. Более того, поддержание клеточного гомеостаза происходит за счет увеличения активности пируватдегидрогеназы, что в условиях ишемии восстанавливает баланс между гликолизом и окислением пирувата в митохондриях и способствует нейтрализации внутриклеточного ацидоза [11]. Также в условиях реперфузии триметазидин обеспечивает быстрое восстановление энергетических фосфатов (АТФ и креатинфосфата), в результате снижая чувствительность кардиомиоцитов к ишемически-р еперфузионным повреждениям, что продемонстрировано на экспериментальных моделях гипоксии и ишемии [12], где отмечалось поддержание электрической и сократительной активности миокарда [13], снижение степени цитолиза [14, 15]. Одним из важных преимуществ также является отсутствие непосредственного вмешательства в параметры системной гемодинамики, в т. ч. АД и ЧСС, а также углеводный обмен, что позволяет использовать триметазидин в лечении пациентов с артериальной гипотензией, нарушениями ритма и проводимости, сахарным диабетом.
В настоящее время имеются данные, которые демонстрируют сравнительную эффективность триметазидина и классических антиангинальных препаратов, таких как β-адреноблокаторы и антагонисты кальция. Доказано, что по антиангинальному действию тиметазидин не уступает вышеуказанным группам препаратов, в той же степени повышая толерантность к физической нагрузке, однако субъективно лучше переносится пациентами [16, 17]. При применении в комбинации с β-блокаторами триметазидин обладает более сильным антиишемическим действием по сравнению с нитратами и антагонистами кальция [18, 19].
Опыт применения триметазидина в мировой практике насчитывает десятилетия. Так, крупный метаанализ 2003 г. (M. Marzilli, W.W. Klein) [20], в котором суммированы данные 12 рандомизированных двой ных слепых плацебо- контролируемых клинических исследований, проведенных с 1985 по 2001 г., посвященных оценке эффективности и переносимости триметазидина как в монотерапии, так и в комбинации с другими антиангинальными препаратами при лечении стабильной стенокардии не менее 2 нед., показал, что применение триметазидина значительно уменьшило количество еженедельных приступов стенокардии у пациентов с ИБС, привело к увеличению времени до регистрации депрессии сегмента ST на 1,0 мм при нагрузочной пробе, улучшило переносимость и продолжительность максимальной нагрузки при стресс- ЭКГ [20].
В многоцентровом рандомизированном двойн ом слепом плацебо- контролируемом международном исследовании с участием 223 пациентов со стабильной стенокардией (класс II или III по классификации Канадского сердечно- сосудистого общества (CCS) [6]) было доказано, что при усилении базовой терапии атенолола в дозе 50 мг (1 р/сут) препаратом триметазидин в дозе 35 мг (2 р/сут) в течение 8 нед. статистически значимо увеличивается время до развития ишемической депрессии сегмента ST на 1 мм на 44,0 с (p = 0,005) при проведении нагрузочных тестов, в группе плацебо подобных изменений не обнаружено. Аналогичные результаты получены также и для времени развития приступов стенокардии (р = 0,049). Не выявлены статистически значимые различия между группами по параметрам безопасности. Указанные данные демонстрируют противоишемическую и антиангинальную эффективность комбинации β-адреноблокатора и триметазидина, а также ее отличную переносимость [21].
Обращает внимание исследование TACT (Trimetazidine in Angina Combination Therapy) [22, 23], целью которого было оценить эффективность и переносимость триметазидина (в дозе 20 мг 3 р/сут) в комбинации с β-адреноблокаторами или нитратами длительного действия у 177 пациентов со стабильной стенокардией II–III ФК по классификации Канадской ассоциации кардиологов [6], резистентных к монотерапии нитратами длительного действия или β-адреноблокаторами (90 пациентов) по сравнению с плацебо (87 пациентов) после 12-недельной терапии. Всего 166 пациентов (80 из группы плацебо и 86 из группы триметазидина) завершили исследование в полном соответствии с протоколом. В результате в конце периода наблюдения продолжительность теста с физической нагрузкой статистически значимо увеличилась с 417,7 ± 14,2 до 506,8 ± 17,7 с в группе триметазидина по сравнению с 435,3 ± 14,8 до 458,9 ± 16,2 с в группе плацебо (p < 0,05). При оценке времени до появления ишемической депрессии ST до 1 мм при нагрузочной пробе отмечено статистически значимое увеличение с 389,0 ± 15,3 до 479,6 ± 18,6 с в группе триметазидина и с 411,8 ± 15,2 до 428,5 ± 17,3 с в группе плацебо соответственно (p < 0,05). Положительный эффект в применении триметазидина продемонстрирован и при анализе времени до появления ангинозной боли при стресс-Э КГ. Так, отмечалось статистически значимое увеличение данного параметра с 417,0 ± 16,9 до 517,3 ± 21,0 с в группе триметазидина по сравнению с 415,1 ± 16,5 до 436,4 ± 18,5 с в группе плацебо (p < 0,005). Кроме того, после 12 нед. терапии в группе триметазидина среднее количество приступов стенокардии в неделю снизилось с 5,6 ± 0,6 до 2,7 ± 0,5 по сравнению с 6,8 ± 0,7 до 5,1 ± 0,7 в группе плацебо (р < 0,05), а среднее потребление нитратов короткого действия в неделю снизилось с 5,2 ± 0,9 до 2,8 ± 0,8 в группе триметазидина в отличие от группы плацебо, где данный параметр изменился всего с 5,5 ± 0,8 до 4,1 ± 0,9, различия между группами статистически значимы (р < 0,05). В исследовании имеются указания на благоприятную переносимость проводимой комбинированной терапии без влияния на гемодинамические параметры при сохранении положительного антиангинального эффекта. [22, 23].
В исследовании Trimetazidine in Elderly People (TRIMER) [24] с включением 72 пациентов (54 мужчины и 18 женщин) старше 65 лет (65–80 лет) со стабильной стенокардией II–III ФК, не полностью контролируемой базовой стандартной комбинированной антиангинальной терапией, включающей нитраты пролонгированого действия, β-адреноблокаторы и антагонисты кальция, получены данные, свидетельствующие о статистически значимом улучшении качества жизни (оценка согласно The Seattle Angina Questionnaire (SAQ) [25] (p < 0,0001), повышении переносимости физических нагрузок (увеличение продолжительности физической нагрузки перед появлением депрессии ST на 1 мм (p < 0,0005), увеличении времени выполнения физической нагрузки до появления клиники стенокардии (p < 0,0001)), уменьшении клинических признаков стабильной стенокардии (статистически значимое уменьшение количества приступов стенокардии (p < 0,01) и уменьшении потребления нитратов короткого действия (p < 0,01)) у пожилых пациентов при добавлении триметазидина в дозе 60 мг/сут в течение 12 нед. [24].
В исследовании H. Szwed et al. [26] с включением 700 пациентов (615 мужчин и 85 женщин) в возрасте от 32 лет до 71 года (средний возраст 54 ± 8,4 года) со стабильной стенокардией, получающих традиционные антиангинальные препараты (нитраты пролонгированного действия, β-адреноблокаторы или антагонисты кальция) с недостаточным эффектом, к терапии в течение 4 нед. был добавлен триметазидин. В результате после 4 нед. лечения отмечалось статистически значимое увеличение времени физической нагрузки (с 443,7 до 486,6 с, p < 0,01), максимальной мощности нагрузки (10,6 против 9,4 МЕТs, p < 0,01), увеличение времени физической нагрузки до появления на ЭКГ депрессии сегмента ST на 1 мм (до 389,9 с после терапии против 337,8 с до инициации терапии триметазидином, p < 0,01) и увеличение времени до появления стенокардии (450,3 против 251,7 с, p <0,01). Также было зафиксировано значительное уменьшение количества ежедневных приступов стенокардии (с 3,66 до 2,47, p < 0,01) и уменьшение потребности в дополнительном использовании короткодействующих нитратов (с 2,94 до 1,80, p < 0,01) [26].
В российском исследовании ТРИУМФ [27], в котором приняли участие 846 пациентов со стабильной стенокардией, уже получающих традиционную антиангинальную терапию, но имеющих недостаточный контроль симптомов заболевания, исследовали эффективность и переносимость триметазидина замедленного высвобождения в дозе 70 мг/сут в течение 3 мес. Было доказано, что наряду со снижением количества приступов стенокардии и потребления короткодействующих нитратов в неделю (более чем в 3 раза) статистически значимо улучшилось качество жизни пациентов [27].
В другом российском исследовании – ПАРАЛЛЕЛЬ [28] – проводилась оценка эффективности антиангинальной терапии и качества жизни пациентов со стабильной стенокардией старше 60 лет, страдающих сахарным диабетом или перенесших инсульт в параллельных группах, получавших комбинированную терапию β-адреноблокатором с изосорбида динитратом или триметазидином в дозе 70 мг/сут в течение 12 нед. Согласно полученным данным, к окончанию периода наблюдения комбинация триметазидина МВ и β-адреноблокатора обеспечила более значимый антиангинальный эффект, чем добавление изосорбида динитрата, что проявлялось в снижении частоты приступов стенокардии, уменьшении потребности в нитратах короткого действия и улучшении качества жизни пациентов при оценке по специализированному опроснику SAQ [28].
Заключение
Таким образом, при выборе антиангинальной терапии у пациентов со стабильной стенокардией необходимо рассматривать возможность применения комбинаций препаратов как первой, так и второй линии с целью реального повышения эффективности лечения, его безопасности и переносимости, и достижения главных целей терапии – снижения клинических проявлений стенокардии, улучшения качества жизни пациентов и прогноза заболевания, связанного со снижением риска ССО. Целесообразно и оправдано более широкое применение препаратов второй линии, в частности триметазидина, на любом этапе терапии стабильной стенокардии для усиления антиангинальной эффективности β-адреноблокаторов, антагонистов кальция и нитратов пролонгированного действия, особенно у пациентов с особенностями гемодинамики (артериальная гипотония, нарушения ритма и проводимости), что продемонстрировано в приведенном клиническом примере. Дополнение триметазидина к арсеналу традиционных антиангинальных препаратов эффективно применяется в практической деятельности и отражено в новых клинических рекомендациях Министерства здравоохранения РФ 2020 г. [2]. Накопленный опыт использования триметазидина позволяет патогенетически обоснованно подходить к терапии стабильной ИБС, влияя на восстановление баланса между потребностью в кислороде и его доставкой к сердечной мышце, а профиль безопасности расширяет возможности применения препарата у пациентов с коморбидной патологией и (или) старших возрастных групп.
На российском фармацевтическом рынке имеется препарат Депренорм® ОД 70 мг пролонгированного высвобождения (ЗАО «Канонфарма Продакшн», Россия) с кратностью приема 1 р/сут утром. Именно его мы использовали при лечении пациента, клинический пример которого описан в настоящей статье. Высокая эффективность и безопасность Депренорма, удобный режим дозирования (1 р/сут утром), несомненно, способствуют повышению приверженности пациентов к лечению и, следовательно, повышению его эффективности.
