Содержание
Приведены результаты исследованиятрансмитрального кровотока и проаритмических маркеров у пациентов с относительной коронарной недостаточностью на фоне терапии триметазидином
Резюме
Опыт применения триметазидина у пациентов с ишемической болезнью сердца (ИБС) доказал его эффективность в отношении не только показателей болевой и безболевой ишемии миокарда, но и повышения толерантности к физической нагрузке, а также увеличения глобальной сократимости левого желудочка (ЛЖ) и уменьшения аритмических проявлений. Однако недооцененной остается эффективность цитопротекторной терапии у пациентов с относительной коронарной недостаточностью.
Цель исследования: оценить влияние триметазидина (Депренорм МВ 70 мг) на объемные и скоростные характеристики заполнения ЛЖ, количество желудочковых экстрасистол у пациентов с относительной коронарной недостаточностью на фоне ГЛЖ.
Материал и методы: 66 пациентов с гипертонической болезнью (ГБ), у которых по данным эхокардиографии были выявлены умеренно выраженная ГЛЖ и полностью сохраненная его систолическая функция, а по показателям трансмитрального кровотока – диастолическая дисфункция ЛЖ в виде нарушенной релаксации и псевдонормализации. Проводились холтеровское мониторирование ЭКГ с оценкой проаритмических маркеров (турбулентности сердечного ритма и микроальтернации зубца Т). Базовую терапию ГБ дополняли 3-месячным применением триметазидина в дозе 70 мг 1 р./сут (Депренорм МВ 70 мг, ЗАО «Канонфарма продакшн»). Контрольную группу составили 59 пациентов с ГБ с сопоставимыми показателями гипертрофии миокарда и систолической функции ЛЖ, а также сходными характеристиками трансмитрального кровотока, которым проводилась антигипертензивная терапия в соответствии с Национальными рекомендациями диагностики и лечения пациентов с артериальной гипертонией.
Результаты: выявлена сильная корреляция между характеристиками трансмитрального кровотока, количественными характеристиками желудочковой экстрасистолии и проаритмическими маркерами в виде турбулентности сердечного ритма и микроальтернации зубца Т. Допплеровские показатели у больных на фоне традиционной терапии достоверно не изменились.
Выводы: включение препарата триметазидина (Депренорм МВ 70 мг 1 р./сут) в терапию ГБ привело к достоверному улучшению большинства амплитудных и временных характеристик трансмитрального кровотока у пациентов с нарушенной релаксацией.
Повышение эффективности утилизации кислорода при его недостаточной доставке в рамках как абсолютной, так и относительной коронарной недостаточности происходит за счет изменений качественных и количественных характеристик внутриклеточных метаболических превращений, что лежит в основе действия триметазидина [1, 2]. Многолетний опыт применения триметазидина у пациентов с ИБС, а соответственно, с абсолютной коронарной недостаточностью, доказал его высокую эффективность в отношении качественно-количественных показателей болевой и безболевой ишемии миокарда, повышения толерантности к физической нагрузке, увеличения глобальной сократимости ЛЖ, уменьшения аритмических проявлений как в рамках стабильно текущей коронарной патологии, так и при ее острых формах [3–12].
По нашему мнению, эффективность цитопротекторной терапии у пациентов с относительной коронарной недостаточностью является недооцененной. Целый ряд факторов, таких как структурные изменения сосудистой стенки коронарных артерий мышечного типа, несоответствие массы миокарда и возможностей коронарного русла, снижение градиента давления между ЛЖ и аортой, нарушенная пространственная ориентация кардиомиоцитов в гипертрофированном миокарде, гиперконтрактильность гипертрофированного миокарда являются основой формирования относительной коронарной недостаточности [13–16].
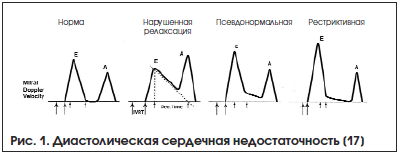
Наиболее распространенными и достоверными характеристиками для оценки состояния диастолической функции ЛЖ до настоящего времени являются амплитудные и скоростные показатели трансмитрального кровотока (рис. 1) [17].
Развитие систем холтеровского мониторирования ЭКГ в настоящее время позволяет наряду с традиционными оценками ишемического и аритмического синдромов выявлять целый ряд прогностических показателей (временные и спектральные показатели вариабельности сердечного ритма, дисперсия интервала QT, турбулентность сердечного ритма, микроальтернация зубца Т), что, безусловно, расширяет диагностические, лечебные и прогностические возможности ведения пациентов [1].
Материал и методы
В исследование, проведенное в 2013–2016 гг., было включено 125 пациентов с ГБ (75 женщин и 50 мужчин, средний возраст – 58,4±6,3 года), находившихся на стационарном лечении в терапевтическом и 2-м кардиологическом отделениях ГКБ № 13 ДЗ г. Москвы. В период 2010–2016 гг. всем пациентам, включенным в исследование, в различных лечебных учреждениях на основании клинической картины, положительной или сомнительной ЭКГ-нагрузочной пробы или выявления преходящей ишемии миокарда при проведении холтеровского мониторирования ЭКГ были проведены либо мультиспиральная компьютерная томография коронарных артерий, либо коронароангиография, по результатам которых не было выявлено признаков диагностически значимого коронарного поражения. В дальнейшем, через 3–3,5 мес. лечения, проводилась амбулаторная динамическая клиническая и инструментальная оценка эффективности проведенной терапии. Среди обследуемых больных были выделены 2 группы. В основную группу были включены 66 пациентов, получавших базовую терапию бета-адреноблокаторами, ингибиторами АПФ / блокаторами рецепторов ангиотензина II, блокаторами кальциевых каналов, мочегонными препаратами, дезагрегантами и триметазидином в дозировке 70 мг 1 р./сут (Депренорм МВ 70 мг, ЗАО «Канонфарма продакшн»). Контрольную группу составили 59 пациентов с сопоставимыми анамнестическими, возрастными, нозологическими, инструментальными характеристиками, получавших базовую терапию.
Критериями включения в исследование были: наличие клинических и инструментальных признаков ГБ; фракции выброса ЛЖ (ФВЛЖ) выше 55%; толщины задней стенки левого желудочка (ТЗСЛЖ) и межжелудочковой перегородки (ТМЖП) от 12 до 14 мм; наличие допплеровских критериев диастолической дисфункции ЛЖ в виде замедленного расслабления или псевдонормализации трансмитрального потока; наличие поздней частой монотопной желудочковой экстрасистолии, соответствующей 2 градации по B. Lown.
В исследование не включали пациентов: с клинической картиной ИБС, признаками обструкции выходного тракта ЛЖ, некорригируемой артериальной гипертензией (АГ) (с повышением систолического АД свыше 220 мм рт. ст., диастолического АД – свыше 110 мм рт. ст.); нарушением сердечного ритма и проводимости (постоянная форма фибрилляции – трепетания предсердий, желудочковая экстрасистолия выше 2 градации по B. Lown, полные блокады ножек пучка Гиса, наличие искусственного водителя ритма). В основной и контрольной группах выделяли подгруппы пациентов в зависимости от типа нарушения диастолической функции ЛЖ. При первичном обследовании в стационаре и через 3–3,5 мес. оценивали следующие показатели: эхокардиографические показатели ТЗСЛЖ (мм), ТМЖП (мм), конечного диастолического размера левого желудочка (КДРЛЖ, мм), ФВЛЖ (%), индекса массы миокарда левого желудочка (ИММЛЖ, г/м2); допплеровские показатели трансмитрального потока Е (см/с), А (см/с), Е/А, IVRT (mc). По результатам холтеровского мониторирования ЭКГ в динамике оценивали: количество желудочковых экстрасистол, микроальтернацию зубца Т (мкВ), динамику количества пациентов с патологическими показателями турбулентности сердечного ритма.
Статистическая обработка материала проводилась согласно общепринятой методике при использовании программы Statistica v.7.0. Количественные признаки с нормальным распределением представлены как М±SD (среднее ± стандартное отклонение). Проводили корреляционное сопоставление некоторых показателей по критерию r (по К. Пирсону).
Результаты
На протяжении 3-месячного динамического наблюдения достоверного изменения толщины задней стенки ЛЖ, толщины межжелудочковой перегородки, конечного диастолического размера ЛЖ, фракции изгнания ЛЖ, индекса массы миокарда ЛЖ как в основной, так и в контрольной группе не отмечено.
При оценке динамики амплитудных и скоростных показателей трансмитрального кровотока у пациентов основной группы на фоне терапии препаратом Депренорм МВ 70 мг 1 р./сут произошло достоверное увеличение периода раннего наполнения ЛЖ на 14,3% (р<0,05), увеличилось соотношение обеих фаз заполнения ЛЖ на 18,7% (р<0,05). В контрольной группе пациентов ни один из показателей достоверно не изменился (табл. 1).
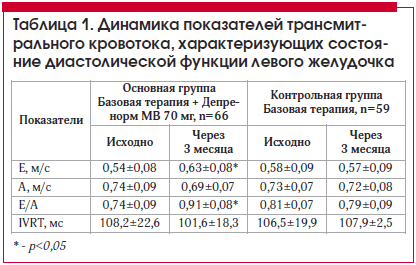
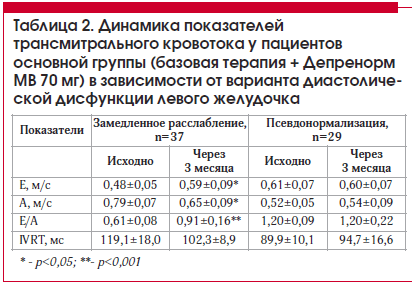
При динамической оценке показателей трансмитрального кровотока у пациентов основной группы в зависимости от типа диастолической дисфункции (нарушенная релаксация и псевдонормализация) на фоне лечения триметазидином достоверное изменение показателей было отмечено только в подгруппе пациентов с нарушенной релаксацией. Так, фаза раннего наполнения ЛЖ увеличилась на 18,6% (р<0,05), фаза позднего наполнения уменьшилась на 17,7% (р<0,05), а соотношение обеих фаз увеличилось на 33,0% (р<0,001) (табл. 2).
Исходное количество желудочковых экстрасистол (их качественная характеристика соответствовала 2 градации по B. Lown) в основной и контрольной группах пациентов достоверно не различалось. На фоне терапии препаратом Депренорм МВ 70 мг 1 р./сут количество желудочковых экстрасистол достоверно уменьшилось на 27,8% (р<0,001). При внутригрупповом сопоставлении в основной группе отмечено, что у пациентов с замедленным расслаблением на фоне терапии препаратом Депренорм МВ 70 мг 1 р./сут достоверно уменьшилось количество желудочковых экстрасистол на 30,9% (р<0,001) (табл. 3).

Оценивая количественные значения проаритмогенного маркера в виде микроальтернации зубца Т, мы отметили, что его исходные значения и в основной, и в контрольной группе достоверно не различались, а их абсолютные значения составили соответственно 94,5±14,8 и 97,3±17,6 мкВ (р>0,05). В динамике отмечено достоверное уменьшение микроальтернации зубца Т на 26,4% (р<0,05) только в основной группе пациентов, получавших терапию препаратом Депренорм МВ 70 мг 1 р./сут, в контрольной группе этот показатель уменьшился лишь на 7,9% (р>0,05). При сопоставлении внутригрупповой динамики в основной группе, получавшей Депренорм МВ 70 мг 1 р./сут, отмечено, что на фоне терапии пациентов с псевдонормализацией достоверно снизились показатели микроальтернации зубца Т со 102,4±12,1 до 76,1±7,3 мкВ (26,7%; р<0,05).
Обсуждение
Опыт клинического применения триметазидина у пациентов с относительной коронарной недостаточностью на фоне гипертрофии миокарда ЛЖ минимален. Более активно использовался триметазидин в дозе 60 мг/сут в течение 2-х мес. у пациентов с сочетанием низкой ФВЛЖ (менее 33%) и диастолической сердечной недостаточностью в виде рестрикции, что привело к увеличению участков жизнеспособного миокарда по данным стресс-эхокардиографии на 8% от исходного уровня. И только последующий прием препарата в течение 6 мес. способствовал достоверному увеличению ФВЛЖ до 44,1% (р<0,05) и улучшению диастолической дисфункции от рестрикции до псевдонормализации (р<0,05) [18]. У пациентов с систолической и диастолической ХСН на фоне сахарного диабета 2-го типа терапия триметазидином в дозе 60 мг/сут в течение 6 мес. привела к достоверному увеличению ФВЛЖ и улучшению диастолического расслабления ЛЖ (увеличение отношения Е/А) [19].
Наш опыт изучения влияния препарата Депренорм МВ 70 мг на показатели трансмитрального кровотока у пациентов с изолированной диастолической сердечной недостаточностью на фоне достоверно доказанного отсутствия диагностически значимого коронарного атеросклероза в значительной степени указывает на возможность обратимости изменений в жизнеспособном миокарде [1, 6]. Трехмесячное применение препарата Депренорм МВ 70 мг 1 р./сут позволило нам получить достоверное улучшение важнейших показателей трансмитрального кровотока, характеризующих более адекватное заполнение ЛЖ в раннюю фазу.
Мы не получили значимого изменения изучаемых показателей у пациентов с псевдонормализацией трансмитрального потока. По нашему мнению, в основе недостаточной эффективности триметазидина у пациентов с «тяжелыми» диастолическими характеристиками трансмитрального потока лежит целый ряд причин: имеющиеся признаки интерстициального миокардиального фиброза, изменения в стенке коронарных артерий мышечного типа у пациентов с псевдонормализацией (а тем более с рестрикцией) более выражены и, в определенной степени, необратимы, что лишает триметазидин морфофункционального субстрата его действия.
Эффективность терапии триметазидином у пациентов с сочетанием систолической и диастолической сердечной недостаточности в определенной степени зависит от ее длительности (до 6–8 мес.).
Заключение
Включение в комплексную терапию 3-месячного приема препарата Депренорм МВ 70 мг (триметазидин однократного приема) у пациентов с относительной коронарной недостаточностью на фоне ГЛЖ показало его высокую эффективность у пациентов с диастолической дисфункцией в виде нарушенной релаксации: улучшились объемные и скоростные характеристики заполнения ЛЖ, достоверно уменьшилось количество желудочковых экстрасистол и таких проаритмических маркеров, как микроальтернация зубца Т и турбулентность сердечного ритма.
Важным аспектом данной работы мы считаем выявленные антиаритмические и антипроаритмические эффекты препарата Депренорм МВ 70 мг 1 р./сут у пациентов с нарушенной релаксацией, что, безусловно, диктует необходимость максимально раннего его назначения пациентам с признаками относительной коронарной недостаточности на фоне ГЛЖ.