Содержание
Резюме
Результаты метаанализа более 20 клинических исследований применения различных доз и схем назначения триметазидина больным стабильной ишемической болезнью сердца (ИБС) позволили рассматривать суточную дозу триметазидина 70 мг как стандартную терапевтическую дозу.
С помощью метода математического моделирования показано, что прием препарата Депренорм® МВ 70 мг однократно в сутки сокращает кратность снижения концентрации в плазме крови до 1 р/сут, вместо 2 р/сут (каждые 12 ч) в случае с препаратом сравнения.
С фармакологической точки зрения однократное применение препарата Депренорм МВ 70 мг, содержащего стандартную суточную дозу триметазидина, имеет более выраженный клинический эффект по сравнению с приемом триметазидина 35 мг 2 р/сут и позволяет достигать высокой комплаентности у больных ИБС.
Ключевые слова: ишемическая болезнь сердца, хроническая сердечная недостаточность, стенокардия, прекондиционирование, цитопротекция, триметазидин, оригинальный препарат, дженерик, фармакотерапия.
[1] Институт профессионального образования Первого Московского государственного медицинского университета им. И.М. Сеченова Минздрава России
[2] Центральный научно-исследовательский институт организации и информатизации здравоохранения Минздрава России
Обзор
Несмотря на успехи в понимании патогенеза и возможности современной фармакотерапии, ишемическая болезнь сердца (ИБС) является основной причиной инвалидизации и смертности больных в экономически развитых странах. В последнее десятилетие достигнут значительный прогресс в лечении больных ИБС благодаря активному использованию современных лекарственных средств (ЛС) и инвазивных методов лечения [1, 2]. Однако уровень ежегодной смертности больных стабильной стенокардией, самой многочисленной группы больных ИБС, по-прежнему остается высоким и составляет 2–3% [3]. Качество жизни таких больных, как правило, снижено: наблюдаются значительные ограничения в повседневной жизни главным образом из-за возникающих приступов стенокардии [4, 5].
В связи с этим важная роль в практическом здравоохранении отводится разработке новых и оптимизации уже имеющихся подходов к лечению ИБС.
К настоящему времени накоплен большой опыт по применению антиангинальных ЛС у больных стабильной стенокардией: нитропрепаратов, блокаторов бета-адренорецепторов (БАБ), ингибиторов If-каналов синусового узла и антагонистов кальция (АК), объективно влияющих на качество жизни таких больных [4].
Длительное время для устранения и уменьшения частоты приступов стенокардии традиционно использовались нитраты. Однако нитраты нередко дают побочные эффекты, наиболее частым из которых является появление головной боли. Необходимость длительного приема нитратов в больших дозах зачастую приводит к развитию толерантности в виде ослабления антиангинального и антиишемического действий [5].
Многолетний опыт применения БАБ свидетельствует о том, что эта группа ЛС способна улучшать отдаленный прогноз у больных ИБС, в первую очередь это касается больных ИБС, перенесших острый инфаркт миокарда (ИМ). По данным ряда крупных контролируемых КИ, долгосрочное лечение БАБ способствует улучшению качества жизни и снижению смертности у больных стенокардией напряжения [6].
АК представляют собой большую и весьма неоднородную по химической структуре и фармакологическим свойствам группу ЛС, общим свойством которых является конкурентный антагонизм в отношении потенциал-зависимых кальциевых каналов. Механизм действия АК заключается в том, что они уменьшают потребность миокарда в кислороде за счет снижения уровня артериального давления, частоты сердечных сокращений (ЧСС) и сократительной способности миокарда. Увеличение доставки кислорода к миокарду осуществляется за счет устранения спазма коронарных артерий, улучшения коронарного кровотока и увеличения коллатерального кровообращения [7].
Однако применение ЛС гемодинамического действия (БАБ, АК, нитраты) не всегда эффективно контролирует симптомы стенокардии даже при применении их в комбинации, поскольку механизм их действия ориентирован либо на повышение получения кислорода кардиомиоцитами, либо на снижение потребности миокарда в кислороде, что достигается посредством урежения ЧСС или вазодилатации [4].
ЛС, влияющие на гемодинамические параметры, эффективны, когда речь идет о профилактике приступов стенокардии, но при этом фактически не защищают клетку миокарда от ишемических изменений. Более того, недостаточный антиангинальный/антиишемический эффект, по-видимому, связан с тем, что возможности антиангинальной терапии ограничены пределами функционирования миокарда при ишемии, а также наличием других адаптационных процессов, оказывающих существенное влияние на кардиомиоциты и миокард в целом. Это диктует необходимость дальнейшего поиска и совершенствования медикаментозного воздействия на ишемизированный миокард с учетом формирования новых представлений о патогенезе стабильной ИБС и нарушений, происходящих в метаболизме кардиомиоцитов при гипоксии.
Показано, что ишемические изменения в миокарде на клеточном уровне характеризуются снижением окисления глюкозы и повышением использования свободных жирных кислот (СЖК). Резкий дисбаланс между окислением глюкозы и использованием жирных кислот, а также повышение концентрации СЖК в ишемизированной зоне миокарда являются основными факторами риска реперфузионного повреждения и дисфункции миокарда, развития опасных нарушений ритма сердца [8].
Понимание биохимических процессов, протекающих в ишемизированном миокарде, привело к созданию ЛС, способных воздействовать на определенные звенья патогенеза ишемии. В настоящее время эффективное лечение и профилактика приступов стенокардии невозможны без применения метаболической терапии. Оптимальным механизмом действия метаболической терапии является улучшение эффективности поглощения кислорода миокардом в условиях ишемии [9–11].
В современной кардиологической практике для лечения больных ИБС широко используются ЛС с метаболическим действием: триметазидин, ранолазин, тиотриазолин, L-карнитин, милдронат и др. Наиболее изученными ЛС, блокирующими окисление СЖК, являются p-FOXингибиторы (partial fatty and oxidation inhibitors), к которым относится хорошо зарекомендовавший и широко используемый в повседневной практике врача триметазидин. Высокая эффективность триметазидина в лечении ИБС объясняется его прямым цитопротекторным антиишемическим действием [12].
Механизм действия триметазидина заключается в том, что под его воздействием в условиях ишемии нормализуется энергетический метаболизм клеток путем оптимизации использования кислорода миокардом за счет усиления аэробного гликолиза и уменьшения интенсивности окисления СЖК. Триметазидин предотвращает снижение внутриклеточного содержания аденозинтрифосфата, что способствует сохранению сократительной функции кардиомиоцитов и миокарда в целом. В условиях ишемии и реперфузии под влиянием триметазидина в кардиомиоцитах уменьшается внутриклеточный ацидоз и накопление ионов Na+ и Са2+, происходит улучшение процессов окислительного фосфорилирования с уменьшением продукции митохондриями свободных радикалов [12].
Доказанное свойство триметазидина оказывать положительное действие на уменьшение образования свободных радикалов – недоокисленных продуктов обмена, а также регулировать активность ключевого этапа энергетического метаболизма миокарда – бетаокисления СЖК является фактором, объясняющим усиление антиангинальной эффективности нитратов у больных стабильной стенокардией.
Доказанное свойство триметазидина оказывать положительное действие на уменьшение образования свободных радикалов, а также регулировать активность бетаокисления СЖК является фактором, объясняющим усиление антиангинальной эффективности нитратов.
Научные достижения последних лет позволили развить новые подходы к лечению пациентов с ИБС, учитывающие знание биологических процессов на молекулярном уровне. Р.W. Hochachka еще в 1996 г. предположил, что жизнеспособность миокарда в условиях ишемии обеспечивается адаптацией к гипоксии. К наиболее значимым приспособительным реакциям миокарда в ответ на ишемию относятся так называемые «новые ишемические синдромы»: гибернация, оглушенность и прекондиционирование [13].
Благоприятные (кардиопротективные) эффекты ишемического прекондиционирования выражаются в уменьшении размера инфаркта, улучшении механической функции сердца, снижении частоты желудочковой аритмии на фоне ишемии, которая без реализации этого феномена привела бы к гораздо более серьезным клиническим последствиям или даже к летальному исходу. Кроме того, ишемическое прекондиционирование уменьшает степень повреждения ткани миокарда в результате реперфузии. Эти эффекты продемонстрированы не только в многочисленных экспериментах на животных, но и в реальных КИ [13].
Положительный эффект прекондиционирования может быть стимулирован с помощью регулярной физической активности, а также ряда лекарственных препаратов. Одним из ЛС, полностью воспроизводящих данный механизм, является триметазидин, который повышает содержание аденозина и тем самым обеспечивает явление фармакологического прекондиционирования.
Триметазидин – первый препарат из группы миокардиальных цитопротекторов, рекомендованный экспертами различных профессиональных медицинских сообществ (ЕОК, АКК/ААС, ВНОК) в качестве антиангинального средства для лечения больных стабильной стенокардией на основании результатов многочисленных КИ, проведенных как за рубежом, так и в нашей стране [14–17].
Согласно Российским рекомендациям по диагностике и лечению стабильной стенокардии, триметазидин показан к назначению на любом этапе терапии стабильной ИБС для усиления антиангинальной эффективности гемодинамически активных препаратов (БАБ, АК или нитратов), а также в качестве альтернативы им при их непереносимости или противопоказаниях к их применению [18, 19].
В отечественном исследовании ПАРАЛЛЕЛЬ (2007) показано, что добавление триметазидина к БАБ при лечении больных ИБС имело преимущество перед добавлением к БАБ изосорбида динитрата (в исследование включено 903 пациента ИБС, длительность лечения – 3 мес.). Авторы делают вывод о том, что при длительном применении нитратов у больных ИБС развивается толерантность, тогда как при длительном лечении триметазидином отмечено значительное снижение частоты приступов стенокардии.
В ряде исследований, в т. ч. плацебо-контролируемых, продемонстрировано положительное влияние триметазидина как на динамику показателей ремоделирования левого желудочка, так и функциональное состояние больных ХСН, осложнившей течение ИБС. В настоящее время доказано, что при ХСН в условиях тканевой гипоксии, помимо нейрогуморальных расстройств, существуют и другие процессы, оказывающие существенное влияние на кардиомиоциты и миокард в целом, тем самым способствующие изменению структуры и функции сердца и прогрессированию заболевания [4].
Триметазидин – первый препарат из группы миокардиальных цитопротекторов, рекомендованный экспертами в качестве антиангинального средства для лечения больных стабильной стенокардией.
Высокий оксидативный стресс, усиление процессов перекисного окисления и дефицит в миокарде и плазме крови ряда субстанций, обеспечивающих физико-химические свойства мембран клеток и метаболические процессы, в т. ч. перенос электронов в митохондриях, поступление глюкозы в кардиомиоциты, сопряжение процессов гликолиза и окисления глюкозы приводят к нарушениям электролитного и кислотно-щелочного баланса. При этом миокард оказывается в условиях, при которых возникает массовый апоптоз клеток, что несовместимо с поддержанием адекватной сократительной функции сердца.
Хотя прямого влияния на гемодинамику и контрактильную функцию сердца триметазидин не оказывает, но его применение создает условия для восстановления нормального метаболизма миокарда. Это приводит к положительной динамике конечного диастолического и конечного систолического размеров и фракции выброса левого желудочка, усиливает действие основных лекарств и способствует устранению феномена «ускользания эффекта», что связано с изменением функционального состояния ишемизированных кардиомиоцитов под влиянием приема триметазидина [20].
В настоящее время эффективное лечение и профилактика приступов стенокардии невозможны без применения метаболической терапии. Оптимальным механизмом действия метаболической терапии является улучшение эффективности поглощения кислорода миокардом в условиях ишемии.
Это послужило основанием для применения триметазидина при ХСН ишемической этиологии, особенно у больных со стенокардией и перенесших ИМ. Более того, триметазидин целесообразно назначать больным ХСН с сопутствующим сахарным диабетом, для которого характерна высокая степень утилизации миокардом жирных кислот [17].
К настоящему времени накоплен достаточный опыт применения триметазидина в дозе 35 мг дважды в сутки в лекарственной форме с модифицированным высвобождением активного вещества, равномерно распределенного в объеме гидрофильного матрикса. Это позволяет обеспечить замедленное контролируемое высвобождение действующего вещества, увеличить плато концентрации триметазидина в крови в течение суток и возможность поддерживать постоянную антиангинальную эффективность триметазидина в течение 24 ч.
Результаты исследования по оценке влияния триметазидина в дозе 35 мг 2 р/сут на кумулятивную выживаемость 119 больных ИБС, осложненной хронической сердечной недостаточностью, показали, что к концу 6-летнего наблюдения у больных ИБС, принимавших триметазидин, этот показатель составил 0,848 против 0,698 в группе больных, не принимавших триметазидин (p = 0,044). Более того, прием триметазидина МВ в дозе 35 мг дважды в день к концу 4 мес. лечения приводило к улучшению функции эндотелия – увеличению эндотелий-зависимой дилатации плечевой артерии на 32% [21].
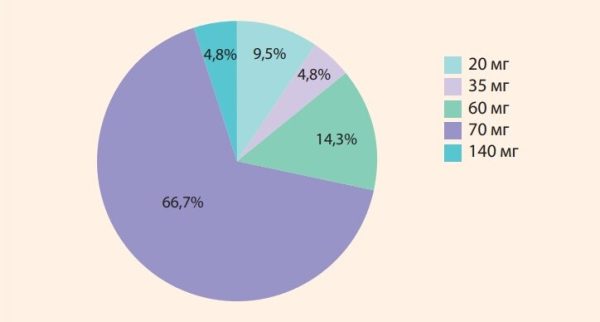
Важным вопросом при лечении больных ИБС является выбор дозирования ЛС, режим и длительность его приема. Результаты метаанализа 21 КИ применения триметазидитазидина, с различными торговыми названиями у больных стабильной стенокардией II–III ФК (по базам данных научных медицинских статей Elibrary, PubMed, Google Scholar и др.) показали, что в 14 (66,7%) иссле дованиях триметазидин применялся в суточной дозе 70 мг, при этом в 12 КИ из 14 – в дозе по 35 мг дважды в день (рис. 1).
Рисунок 1. Частота назначения различных дозировок триметазидина в клинических исследованиях (метаанализ, 1 352 больных)
Сравнительная оценка влияния двух доз триметазидина 70 и 140 мг/сут (исследование VASCO angina) на общую продолжительность физической нагрузки (ОПФН) и время до появления депрессии сегмента ST на 1 мм у больных ИБС и стабильной стенокардией, находившихся на терапии атенололом, показала, что под влиянием обеих доз триметазидина достоверно увеличивалась ОПФН (р = 0,0044 и р = 0,0338 для 140 и 70 мг/сут триметазидина соответственно). Отмечена более выраженная динамика ОПФН в группе больных ИБС, получавших триметазидин в суточной дозе 140 мг, однако разница по сравнению с суточной дозой препарата 70 мг была статистически незначимой [22]. Необходимо отметить благоприятный профиль безопасности при применении высоких доз триметазидина у больных ИБС [22, 23].
Результаты исследования VASCO angina и данные метаанализа более 20 КИ позволяют рассматривать суточную дозу триметазидина 70 мг как стандартную терапевтическую при лечении больных ИБС. Триметазидин назначался преимущественно в виде курсов, длительность курсового лечения составила от 2 до 3 мес.
Для определения оптимальной дозы и режима дозирования триметазидина у больных стабильной стенокардией был проведен сравнительный анализ фармакокинетических характеристик препаратов триметазидина 70 мг 1 раз в сутки и 35 мг 2 раза в сутки с применением метода математического моделирования. Построение популяционных ФК моделей дало возможность провести виртуальные испытания с симуляцией многократного приема препаратов при различных дозировках и режимах, а также сравнить стационарные уровни концентраций на большой популяции (500–1000 реплик пациентов).
В качестве препаратов сравнения использовались: Депренорм® МВ 70 мг – единственный препарат триметазидина, имеющий лекарственную форму в таблетках по 70 мг с модифицированным высвобождением действующего вещества для однократного приема (производитель ЗАО «Канонфарма продакшн», Россия) и Предуктал® МВ – таблетки по 35 мг дважды в сутки с модифицированным высвобождением активного вещества (производитель «Лаборатории Сервье» Франция).
Применение математического моделирования в анализе фармакокинетических данных больных ИБС и стабильной стенокардией II–III ФК (n = 40) дало возможность оценить эквивалентность исследуемых ЛС после симуляции многократного приема препаратов и достижения стационарной концентрации ЛС с учетом эффекта накопления. С этой целью были построены популяционные ФК-модели для обоих препаратов, сгенерировано по 500–1000 реплик пациентов с учетом вариабельности индивидуальных параметров абсорбции, объема компартмента и элиминации.
Результаты исследования показали, что режим приема препарата Депренорм® МВ 70 мг однократно в сутки не приводит к снижению концентрации ниже минимальной концентрации препарата сравнения Предуктал® МВ в дозе 35 мг 2 р/сут. В результате многократного приема Депренорма МВ 70 мг однократно в сутки у 90% пациентов в конце фазы элиминации сохраняется концентрация препарата в плазме крови (Cmin) не ниже 8,67– 9,66 нг/мл (рис. 2).
Рисунок 2. Показатели минимальной и максимальной концентрации Депренорма МВ 70 мг в плазме крови больных ИБС с учетом симуляции многократного приема препарата (число реплик – виртуальных пациентов): 1000
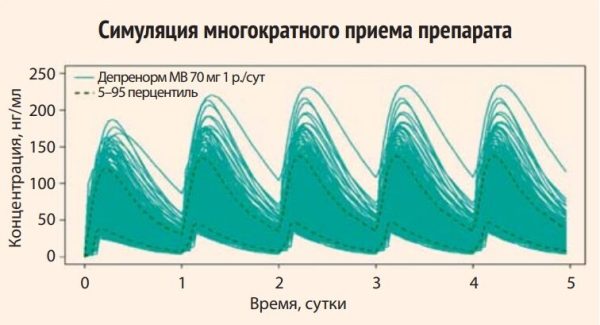
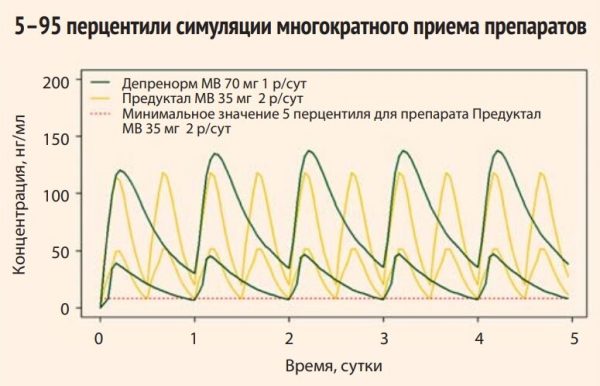
Начиная с 10 перцентиля у больных ИБС, получавших Депренорм® МВ 70 мг однократно в сутки, Cmin была выше по сравнению с группой больных, получавших Предуктал® МВ 35 мг дважды в сутки (8,61–8,81 нг/мл) (рис. 3). На рисунке 4 представлены коридоры значений показателей концентрации для Депренорма (зеленые линии) и Предуктала (желтые линии) между 5 и 95 перцентилями. Красной пунктирной линией обозначено минимальная граница на уровне 5 перцентиля для препарата Предуктал. Выхода кривой 5 перцентиля препарата Депренорм МВ 70 мг ниже этой линии не отмечается.
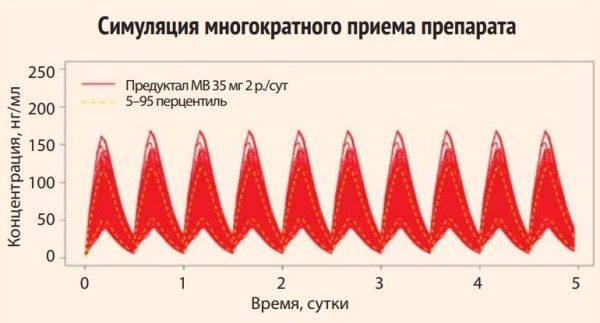
У препарата Депренорм МВ 70 мг Cmin для 95% наблюдений растет от 29,95 нг/мл до 38,43 нг/мл. 95 перцентиль минимальной концентрации (Cmin) препарата Предуктал® МВ 35 мг нарастает в пределах 19,72–21,52 нг/мл. Превышение минимальных эффективных концентраций исследуемого препарата по сравнению с препаратом сравнения доходит почти до 2 раз.
Рисунок 3. Показатели минимальной и максимальной концентрации препарата Предуктал® МВ 35 мг дважды в сутки в плазме крови больных ИБС с учетом симуляции многократного приема препарата (число реплик – виртуальных пациентов): 500
Кроме того, с помощью метода математического моделирования показано, что прием препарата Депренорм® МВ 70 мг однократно в сутки сокращает кратность снижения концентрации в плазме крови до 1 р/сут, вместо 2 р/сут (каждые 12 ч) в случае с препаратом сравнения. После окончания фазы абсорбции происходит плавная элиминация с сохранением терапевтической концентрации препарата в течение 24 ч. При отсутствии резкого падения концентрации следует ожидать стабильного и длительного эффекта от принятой дозы.
На основании вышеизложенного с фармакологической точки зрения однократное применение Депренорма МВ 70 мг, содержащего стандартную суточную дозу триметазидина, имеет более выраженный клинический эффект по сравнению с приемом триметазидина 35 мг 2 р/сут.
Рисунок 4. Интервалы 5 и 95 перцентилей значений концентрации препаратов Депренорм МВ и Предуктал МВ по результатам виртуального исследования с симуляцией многократного приема.
Заключение
Таким образом, четкое представление о патофизиологических механизмах повреждения миокардиальных клеток в условиях ишемии, в основе которых лежат метаболические нарушения, обусловливают необходимость включения миокардиального цитопротектора триметазидина в комплексную терапию стабильных форм ИБС.
Препаратом выбора у такой категории больных может быть Депренорм® МВ 70 – единственный препарат триметазидина, имеющий лекарственную форму в таблетках с модифицированным высвобождением действующего вещества (производитель ЗАО «Канонфарма продакшн», Россия) для однократного приема в оптимальной дозе 70 мг. С фармакологической точки зрения однократное применение препарата Депренорм МВ 70 мг, содержащего стандартную суточную дозу триметазидина, имеет более выраженный клинический эффект по сравнению с приемом триметазидина 35 мг 2 р/сут и позволяет достигать высокой комплаентности у больных ИБС.