Содержание
Аннотация
В статье обсуждаются антиишемические и плейотропные эффекты лекарственного препарата из группы миокардиальных цитопротекторов – триметазидина. В настоящее время триметазидин рекомендован специалистами научных медицинских сообществ в качестве эффективного антиангинального препарата для лечения пациентов разного возраста с диагнозом «стабильная стенокардия». Триметазидин, обратимый конкурентный ингибитор 3-кетоацил-кофермента А тиолазы, имеет хороший профиль безопасности и переносимости, улучшает физическую работоспособность у пациентов со стабильной стенокардией и ишемической кардиомиопатией и рассматривается в качестве средства, влияющего на энергетический метаболизм клеток в условиях ишемии, оптимизирующего использование кислорода миокардом за счет усиления аэробного гликолиза и уменьшения интенсивности окисления свободных жирных кислот. Результаты исследования VASCO-angina позволяют рассматривать суточную дозу триметазидина 70 мг как стандартную терапевтическую при лечении пациентов с ишемической болезнью сердца. Исследование КАРДИОКАНОН подтвердило клиническую эквивалентность оригинального и воспроизводимого препарата триметазидин – Депренорм® МВ (производитель ЗАО «Канонфарма продакшн», Россия) при вторичной профилактике ишемической болезни сердца и ее осложнений. Плейотропные эффекты: антиатеросклеротический, противовоспалительный, нефропротективный, нейропротективный – позволяют расширить применение триметазидина в клинической практике.
Ключевые слова: ишемическая болезнь сердца, стенокардия напряжения, метаболизм, ишемия, триметазидин
Для цитирования: Ларина В.Н. Мультисистемный эффект цитопротекции. Consilium Medicum. 2021; 23 (1): 93–98. DOI: 10.26442/20751753.2021.1.200732
ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва, Россия
Введение
Ишемическая болезнь сердца (ИБС) представляет собой поражение миокарда в результате нарушения кровотока по коронарным артериям из-за органических и функциональных изменений (спазм и внутрисосудистый тромбоз) [1].
Согласно рекомендациям Российского общества патологоанатомов, ИБС (или коронарная болезнь сердца) – групповое (родовое) понятие, включающее патологические процессы (нозологические формы), возникающие вследствие острой или хронической ишемии миокарда, обусловленной спазмом, сужением или обструкцией коронарных артерий при их атеросклерозе [2]. Таким образом, понятие ИБС объединяет разные заболевания с общим признаком – наличием ишемии миокарда, которая возникает при несоответствии между количеством доставленной оксигенированной крови и потребностью в ней сердечной мышцы.
Термин «хронические коронарные синдромы», предложенный экспертами Европейского общества кардиологов (ESC) в 2019 г., отражает динамический, прогрессирующий характер течения стабильной коронарной болезни сердца, выражающийся в накоплении структурных и функциональных изменений коронарного кровообращения и возможности его изменения (стабилизация заболевания или регрессия) с помощью образа жизни, фармакотерапии, реваскуляризации [3].
Введение нового термина было направлено на выделение разных вариантов сценариев с целью упрощения ведения пациентов в пределах одного заболевания на различных его стадиях. В отечественных клинических рекомендациях по стабильной ИБС от 2020 г. предпочтение отдается прежней терминологии и классификации [1].
Заболевания сердечно-сосудистой системы, в частности острые и хронические коронарные синдромы, находятся на лидирующих позициях среди летальности населения в мире. Безусловно, меры вторичной и третичной профилактики вносят существенный вклад в улучшение прогноза при данных патологических состояниях [4].
Механизмы развития ишемии миокарда
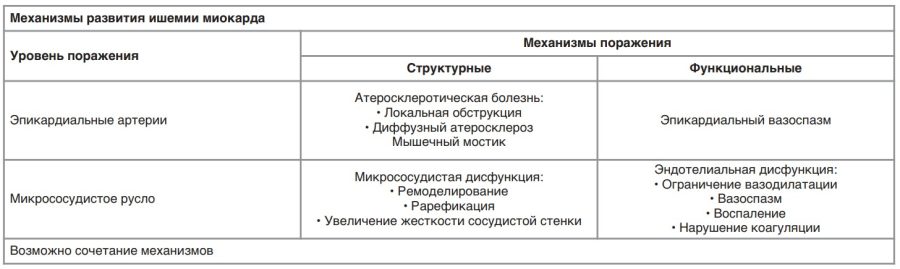
Ишемия миокарда является многофакторным процессом и, как сказано выше, может иметь как структурный, так и функциональный характер (см. таблицу).
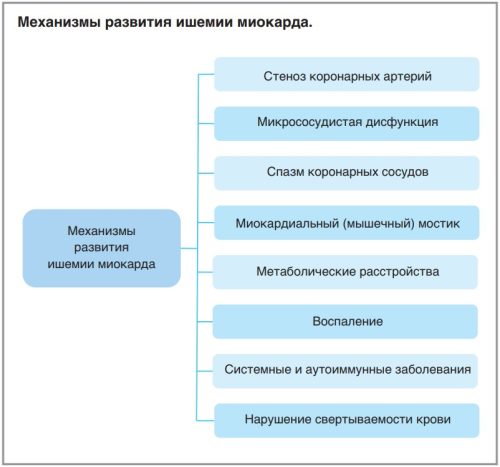
Кроме того, следует учитывать вклад в повышение риска развития ишемии нарушений метаболизма, системных воспалительных и аутоиммунных заболеваний, нарушений функции тромбоцитов и коагуляции (см. рисунок) [5].
Понимание механизмов развития ишемии позволяет врачу определить верную тактику ведения пациента и сделать верный выбор в отношении немедикаментозной и медикаментозной терапии.
Принципы лечения пациентов со стабильным течением ИБС
Основные принципы лечения пациентов со стабильным течением ИБС включают изменение образа жизни, коррекцию факторов риска при их наличии, антиангинальную медикаментозную терапию, что является основой лечения и профилактики осложнений [6, 7].
Рисунок: Механизмы развития ишемии миокарда
Медикаментозные препараты для лечения стенокардии напряжения разделены на средства, улучшающие симптомы заболевания (антиишемические средства) и улучшающие прогноз. Согласно Российским рекомендациям при стабильной стенокардии I–II функционального класса (ФК) и частоте сердечных сокращений (ЧСС)>60 уд/мин в качестве препарата 1-й линии необходимо рассмотреть b-адреноблокаторы (b-АБ) или недигидропиридиновые блокаторы медленных кальциевых каналов (верапамил или дилтиазем) для снижения ЧСС до значений 55–60 уд/мин. При III–IV ФК рекомендовано назначение комбинации b-АБ с дигидропиридиновыми блокаторами медленных кальциевых каналов для достижения ФК I. При недостаточной эффективности препаратов 1-й линии у пациентов со стабильной стенокардией в зависимости от уровня артериального давления, ЧСС и переносимости следует рассмотреть возможность добавления препаратов 2-й линии – органических нитратов, или ивабрадина, или никорандила, или ранолазина, триметазидина [1].
Благодаря своему механизму действия триметазидин обеспечивает кардиопротекторный эффект у пациентов со стенокардией, сахарным диабетом и дисфункцией левого желудочка, а также у лиц, которые проходят процедуры реваскуляризации, без соответствующих побочных эффектов [8–10]. Кроме того, отсутствие влияния на ЧСС, артериальное давление и большинство частых сопутствующих заболеваний делают триметазидин привлекательным препаратом выбора как для пациентов, так и врачей.
Рисунок 2: Механизмы развития ишемии миокарда
Триметазидин как средство, влияющее на энергетический метаболизм клеток в условиях ишемии
В середине 1980-х годов разработано вещество триметазидин, уникальность которого заключается в прямом влиянии на ишемизированный миокард, что способствует более рациональной утилизации поступающего кислорода.
Триметазидин является первым лекарственным препаратом из группы миокардиальных цитопротекторов, который впервые был рекомендован ESC в 1997 г. в качестве препарата для метаболической терапии при стабильной стенокардии напряжения, что было подтверждено в рекомендациях ESC в 2006 г. [11].
В настоящее время триметазидин рекомендован специалистами разных профессиональных научно-практических медицинских обществ (ESC, Американская ассоциация сердца, Российское общество кардиологов и др.) в качестве эффективного антиангинального препарата для лечения пациентов разного возраста с диагнозом «стабильная стенокардия», что основано на результатах контролируемых клинических исследований [1, 3, 6, 12].
Функционирование миокарда зависит от количества доставляемого кислорода, необходимого для производства высокоэнергетического фосфата (аденозинтрифосфата) путем окислительного фосфорилирования. В нормальном сердце аденозинтрифосфат образуется в основном в результате метаболизма свободных жирных кислот (СЖК) и углеводов, при этом 70% его количества синтезируется из СЖК. В здоровом организме поглощение глюкозы и лактата обратно пропорционально уровням СЖК в плазме через цикл Рэндла. СЖК менее эффективны в качестве источника энергии миокарда, поскольку для производства эквивалентного количества аденозинтрифосфата им требуется примерно на 10% больше кислорода, чем глюкозы [13].
Окисление жирных кислот регулируется концентрацией СЖК в плазме, активностью карнитинпальмитоилтрансферазы-1 и b-окислением в митохондриях. Лекарственные препараты, которые ингибируют окисление жирных кислот в кардиомиоцитах, действуют одним из трех способов: подавление высвобождения жирных кислот из адипоцитов (например, b-АБ), торможение ингибитора карнитинпальмитоилтрансферазы-1 и поглощения жирных кислот митохондриями (например, пергексилин), прямое ингибирование b-окисления (например, триметазидин и ранолазин). Триметазидин, обратимый конкурентный ингибитор 3-кетоацил-кофермента А тиолазы, имеет хороший профиль безопасности и переносимости, и в плацебо-контролируемых исследованиях было показано, что он улучшает физическую работоспособность у пациентов со стабильной стенокардией и ишемической кардиомиопатией [14, 15].
Триметазидин рассматривается в качестве средства, влияющего на энергетический метаболизм клеток в условиях ишемии и оптимизирующего использование кислорода миокардом за счет усиления аэробного гликолиза и уменьшения интенсивности окисления СЖК. Данный препарат способствует сохранению сократительной функции кардиомиоцитов и миокарда в целом за счет предотвращения уменьшения внутриклеточного содержания аденозинтрифосфата. В условиях ишемии и реперфузии под влиянием триметазидина в кардиомиоцитах уменьшаются внутриклеточный ацидоз и накопление ионов Na+ и Са2+, происходит улучшение процессов окислительного фосфорилирования с уменьшением продукции митохондриями свободных радикалов [16].
В экспериментальной работе L. Jiang показано, что изолированное введение триметазидина или его комбинация с физической нагрузкой способствовали улучшению антистрессового потенциала мышей, а их комбинация имела синергический эффект, что было связано со стимуляцией аутофагии (p <0,05), апоптоза (p <0,05) и экспрессии белков теплового шока 70 (Heat Shock Protein 70) в клетках миокарда [17]. На сегодняшний день доказано, что белки теплового шока способны стабилизировать и восстанавливать макромолекулярные комплексы клеток организма, участвуют в ряде иммунных реакций, вовлечены в процессы прекондиционирования и адаптации, обладают цитопротективным эффектом, защищая митохондрии за счет вмешательства в вызванные стрессом, апоптические механизмы, что может быть важным для профилактики и лечения ряда заболеваний, включая и сердечно-сосудистые [18].
Прекондиционирование представляет собой один из механизмов адаптации при повторяющихся кратковременных эпизодах ишемии. Кардиомиоциты повышают свою устойчивость к ишемическому воздействию, снижая накопление лактатов и фосфатов и одновременно активизируя синтез ферментов, защищающих от повреждения [19].
Кардиопротективные эффекты ишемического прекондиционирования выражаются в уменьшении размера инфаркта, степени повреждения ткани миокарда в результате реперфузии, улучшении функции миокарда, снижении частоты желудочковых нарушений ритма в условиях ишемии [20]. При инициировании эффекта ишемического прекондиционирования у пациентов с ИБС запускаются механизмы кардиопротекции и метаболической адаптации к нелетальной ишемии, что особенно важно для пациентов со сниженным коронарным резервом [21].
Выраженность и исходы ишемии определяются не только состоянием коронарного кровотока, но и внутриклеточными изменениями миокарда, развивающимися при недостатке кислорода.
Положительный эффект прекондиционирования может быть активирован с помощью регулярной физической активности, а также ряда лекарственных препаратов, полностью воспроизводящих данный механизм, среди которых рассматривается и триметазидин, увеличивающий концентрацию аденозина и обеспечивающий таким образом явление фармакологического прекондиционирования.
Триметазидин в клинической практике
Важнейшей проблемой при лечении пациентов с ИБС является выбор не только эффективного лекарственного препарата, но и его дозировки, кратности и длительности приема.
На сегодняшний день имеется достаточно длительный опыт применения в широкой клинической практике триметазидина в дозе 35 мг, который рекомендован к приему два раза в сутки. Данная лекарственная форма характеризуется модифицированным высвобождением активного вещества, равномерно распределенного в объеме гидрофильного матрикса, что обеспечивает замедленное контролируемое его высвобождение. Все это позволяет увеличить плато концентрации триметазидина в крови в течение суток и возможность поддерживать антиангинальную эффективность в течение 24 ч.
Результаты рандомизированного двойного слепого плацебо-контролируемого исследования VASCO-angina [22] позволяют рассматривать суточную дозу триметазидина 70 мг как стандартную терапевтическую при лечении пациентов с ИБС. В исследовании VASCO-angina оценивалась эффективность двух доз триметазидина (70 и 140 мг/сут) по влиянию на длительность выполнения физической нагрузки и на время до появления депрессии сегмента ST на 1 мм у пациентов с симптомами стабильной стенокардии напряжения на фоне приема атенолола. Показано, что обе дозировки триметазидина статистически значимо увеличили длительность выполнения физической нагрузки (р=0,0044 и р=0,0338 для 140 и 70 мг/сут триметазидина соответственно), способствовали уменьшению индуцированной нагрузки ишемии миокарда и улучшению функциональной способности пациентов, а также продемонстрировали благоприятный профиль безопасности.
В клинической практике врачу нередко приходится выбирать лекарственный препарат среди генериков или оригинальных препаратов. Воспроизведенное лекарственное средство содержит такую же фармацевтическую субстанцию или их комбинацию в такой же лекарственной форме, что и оригинальное лекарственное средство, и поступает в обращение после поступления в обращение оригинального лекарственного средства [23, 24]. Решение данного вопроса является весьма актуальным, в том числе и у пациентов с ИБС и другими сердечно-сосудистыми заболеваниями.
Открытое рандомизированное многоцентровое исследование КАРДИОКАНОН с участием 120 пациентов в возрасте от 40 до 72 лет (58,7±7,7 года) с ИБС и стабильной стенокардией напряжения II–III ФК проводилось в двух параллельных группах пациентов. Пациенты 1-й группы (n=59) получали оригинальные лекарственные препараты для лечения стабильной стенокардии напряжения, 2-й группы (n=61) – воспроизведенные препараты (генерики) компании ЗАО «Канонфарма продакшн». В перечень препаратов входили также препараты метаболического действия – триметазидин (Предуктал® МВ или Депренорм® МВ). В частности, триметазидин применяли 78% пациентов 1-й группы и 85,3% – 2-й группы (p=0,30). Длительность исследования составила 12 нед. Это было одно из первых исследований, направленное на сравнение двух вариантов комплексного лечения, включающего оригинальные препараты или их генерики у лиц со стабильным течением ИБС, для снижения риска сердечно-сосудистых осложнений за счет достижения целевых значений артериального давления, ЧСС, липидного профиля. Актуальность данной работы объясняется тем, что в рутинной практике врача и для пациента крайне важны эффективность и безопасность лекарственной терапии в целом, а не только преимущества и эти составляющие по отдельно взятому препарату. Результаты проведенного исследования показали, что применяемые генерики с доказанной биоэквивалентностью в целом соответствуют по клинической эквивалентности оригинальным препаратам [25].
Данные исследования КАРДИОКАНОН о клинической эквивалентности оригинального и воспроизводимого препарата триметазидин позволяют рассматривать одинаковый клинический эффект двух лекарственных препаратов при вторичной профилактике ИБС и ее осложнений.
Депренорм® МВ 70 мг, используемый в исследовании КАРДИОКАНОН, – единственный препарат триметазидина, имеющий лекарственную форму в таблетках по 70 мг. Данный препарат отличает наличие уникальной матрицы с модифицированным высвобождением действующего вещества для однократного приема (производитель ЗАО «Канонфарма продакшн», Россия, евразийский патент №009810).
Рандомизированное открытое исследование однократной возрастающей дозы (35, 70, 105 мг) триметазидина с модифицируемым высвобождением (по 6 участников – здоровых добровольцев в каждой группе) оценивало фармакокинетику и безопасность разных доз препарата. Пик концентрации лекарственного препарата в крови составил 79,32±23,08, 153,17±23,08 и 199,67±23,08 нг/мл соответственно, время достижения максимальной концентрации вещества в плазме крови – 5,42±0,49, 4,51±1,27 и 4,57±0,96 ч соответственно, период полувыведения составил 7,75±1,62, 6,40±1,23 и 6,50±1,18 ч соответственно, площадь под фармакокинетической кривой – кривой «концентрация–время» – 1116,89±378,35, 1838,39±284,50 и 2504,84±348,35 нг.ч/мл соответственно. Были подтверждены хорошая переносимость и безопасность разовой дозы модифицированного высвобождения препарата [26].
Также показано, что одноразовый прием препарата Триметазидин МВ в дозе 70 мг перед процедурой чрескожной васкуляризации способствует более редкому возможному повреждению миокарда и имеет хороший профиль переносимости [27].
Триметазидин в основном выводится из организма почками в неизменном виде. Почечный клиренс триметазидина коррелирует с клиренсом креатинина, печеночный клиренс снижается с возрастом. Пик концентрации лекарственного препарата в крови достигается через 5 ч, а прием пищи не влияет на его биодоступность. Период полувыведения после приема однократной дозы препарата составляет 6,5 ч*. Следует отметить, что не требуется коррекция дозы у лиц старшего возраста и имеющих нарушение функции почек. Однако следует быть осторожным при выраженном снижении функции почек. Обычно улучшение клинического состояния пациентов наблюдается в течение 2–6 нед от момента начала приема триметазидина.
Кроме антиангинальных эффектов триметазидин обладает и плейотропными эффектами: антиатеросклеротический, противовоспалительный, нефропротективный, нейропротективный, лимитирующий эффекты стресса, что позволяет расширить его применение в клинической практике [28–31].
В исследовании M. Shehata показано, что применение триметазидина в дозе 70 мг в течение 72 ч перед проведением чрескожного коронарного вмешательства (ЧКВ) в плановом порядке у пациентов с сахарным диабетом и нарушением функции почек значимо снижало риск развития контраст — индуцированной нефропатии и повреждения миокарда [32]. В данное исследование были включены 100 пациентов (68% мужчин) в возрасте 59±6 лет со скоростью клубочковой фильтрации 48±16 мл/мин/1,73 м2, которые были рандомизированы в группу приема триметазидина в дозе 70 мг (n=50) и группу контроля (без приема триметазидина, n=50). На фоне лечения уровень креатинина в группе контроля статистически значимо увеличился спустя 3 дня после ЧКВ и снизился к 10-му дню. Контрастиндуцированное повреждение почек отмечено у 12% лиц в группе приема триметазидина и у 28% – группы контроля (р <0,05). Уровень тропонина I статистически значимо уменьшился в группе приема триметазидина по сравнению с группой контроля (через 6 ч после ЧКВ: 8±0,3 пг/мл против 16±0,2 пг/мл, через 12 ч: 13±0,9 пг/мл против 24±0,8 пг/мл, через 24 ч: 7±0,7 пг/мл против 14±0,3 пг/мл соответственно, p<0,001). Авторы исследования сделали заключение, что применение триметазидина до проведения ЧКВ у пациентов с сахарным диабетом со сниженной функцией почек легкой и умеренной степени ассоциировано с уменьшением контрастиндуцированного острого повреждения почек и повреждения миокарда. Данный феномен имеет принципиально важное значение, поскольку помимо прямого цитотоксичного действия рентгеноконтрастных препаратов нельзя исключить вклад воспаления и оксидативного стресса, гипоксического и ишемического повреждения, спазма пре- и ренальных сосудов [33]. Совет экспертов [34] о роли и месте миокардиального цитопротектора триметазидина в терапии пациентов с хроническими формами ИБС пришел к заключению, что метаболическая миокардиальная цитопротекция является неотъемлемым компонентом комплексного лечения пациентов со стабильным течением ИБС, независимо от механизма развития ишемии миокарда. Лечение триметазидином в качестве препарата 2-й линии дополнительно к приему b-АБ или блокаторов кальциевых каналов должно проводиться длительно, начиная с ранних этапов развития болезни, с целью улучшения качества жизни. Данный метаболический препарат целесообразно включать в состав комплексного медикаментозного лечения пациентов с симптомами стабильной стенокардии на этапе подготовки к реваскуляризации миокарда (аортокоронарное шунтирование, чрескожная транслюминальная коронарная ангиопластика) и в послеоперационном периоде, после перенесенного инфаркта миокарда, при хронической сердечной недостаточности и сохранении приступов стенокардии для усиления антиангинального эффекта, несмотря на терапию b-АБ [35], с высоким риском сердечно-сосудистых осложнений (ИБС в сочетании с сахарным диабетом). Клинический эффект триметазидина целесообразно оценивать с помощью нагрузочных проб и эхокардиографического исследования: оценку переносимости физической нагрузки – через 4–8 нед, систолической функции левого желудочка – через 12–16 нед от начала терапии триметазидином.
Заключение
Существующие данные по применению цитопротективного препарата Триметазидин в составе базисной антиангинальной терапии в контролируемых исследованиях и в широкой клинической практике свидетельствуют о его достаточно высокой клинической эффективности и безопасности. Механизм действия препарата основан на увеличении толерантности клеток к ишемии за счет переключения метаболизма с окисления жирных кислот на окисление глюкозы. Многоплановость действия триметазидина включает не только кардио-, но и нейро-, а также нефропротективный эффекты, что позволяет рассматривать данный препарат в качестве надежного средства органопротекции, в том числе у лиц, ожидающих реваскуляризации миокарда.
Однократный прием препарата в дозе 70 мг позволяет не только эффективно контролировать симптомы, но и повысить приверженность пациентов лечению, обеспечивая тем самым лучшее достижение целевых показателей, что принципиально важно для контроля течения заболевания и улучшения прогноза. Необходимы дальнейшие исследования по влиянию триметазидина на смертность и заболеваемость при ишемических синдромах и других состояниях в правильно разработанных контролируемых клинических исследованиях.
