Содержание
Аннотация
Цель. Оценить клиническую эффективность новой формы триметазидина для однократного приема в сутки (Депренорм® МВ 70) у больных с ишемической болезнью сердца (ИБС) и стабильной стенокардией.
Материал и методы. В исследование включены 85 больных с ИБС и стабильной стенокардией. Пациенты рандомизированы в группы приема триметазидина 70 мг однократно в сутки (Депренорм® МВ 70) и плацебо в дополнение к стандартной терапии. Исходно, через 1 и 6 мес. у пациентов определялась тяжесть ИБС с оценкой суточной частоты ангинозных приступов, числа потребляемых в неделю таблеток нитроглицерина, физическая активность методом парных велоэргометрий с расчетом пороговой мощности (ПМ) и объема выполненной работы. Дополнительно в группах была проведена оценка показателей антиокислительной системы организма: концентрация основного липидного эндогенного антиоксиданта α-токоферола и внеклеточного антиоксидантного фермента – церулоплазмина. Результаты. В группе с применением в лечении препарата Депренорм® МВ 70 1 р/сут, в отличие от группы без триметазидина, увеличилась толерантность к нагрузке, и сократилось количество потребляемых больными таблеток нитроглицерина в неделю: к 1-му мес. на 51%, к 6-му – на 80%. В группе препарата Депренорм® МВ 70 отмечалось статистически значимое повышение ПМ: через 1 мес. на 41,3%, через 6 мес. – на 63,4% (p < 0,05) по сравнению с исходным уровнем. Депренорм® МВ 70 оказал положительное влияние на показатели перекисного окисления липидов. Прием плацебо не отразился на величине исследуемых показателей. Заключение. Полученные результаты свидетельствуют о сокращении глубины и продолжительности ишемии на фоне приема препарата Депренорм® МВ 70 (1 табл. 1 р/сут) у больных стабильной стенокардией. Применение препарата Депренорм® МВ 70 улучшает клиническое течение стенокардии и уменьшает потребность в пролонгированных нитратах.
Несмотря на значительные успехи в понимании патогенеза и возможности современной фармакотерапии, ишемическая болезнь сердца (ИБС) является основной причиной инвалидизации и смертности больных в экономически развитых странах. В последнее десятилетие достигнут значительный прогресс в лечении больных ИБС благодаря активному использованию современных лекарственных средств и инвазивных методов лечения [1–3]. Однако уровень ежегодной смертности больных стабильной стенокардией, самой многочисленной группы больных ИБС, по-прежнему остается высоким. Качество жизни таких больных снижено: наблюдаются значительные ограничения в повседневной жизни из-за возникающих приступов стенокардии [4, 5]. По статистике, в мире от сердечно-сосудистых заболеваний умирает 48% населения, повышенное кровяное давление вызывает 51% смертей от инсультов и 45% случаев ИБС (по данным Всемирной организации здравоохранения на 2015 г.). ИБС в течение последних десятилетий является главной причиной смертности населения в экономически развитых странах. Ежегодно в Российской Федерации от сердечно-сосудистых заболеваний умирают более 1 млн человек. ИБС часто развивается у трудоспособных, творчески активных лиц, существенно ограничивая их социальную и трудовую деятельность, усугубляя социально-экономические проблемы в обществе [2].
ИБС – это патологическое состояние, характеризующееся абсолютным или относительным нарушением кровоснабжения миокарда вследствие поражения коронарных артерий сердца. В терапии ИБС используются антиангинальные препараты: нитраты, β-адреноблокаторы (БАБ), антагонисты кальция (АК). Также в терапии ИБС применяются антитромботические препараты (ацетилсалициловая кислота, клопидогрел). В настоящее время важное место в фармакотерапии ИБС занимают препараты метаболического и кардиопротективного действия [4]. Нормализация энергетического метаболизма в кардиомиоцитах является важным и перспективным методом лечения больных ИБС.
Отсутствие влияния на параметры системной гемодинамики, высокая клиническая и биологическая активность миокардиальных цитопротекторов представляют особый интерес при лечении пациентов с ИБС. При дефиците кислорода в условиях временной или постоянной ишемии миокарда метаболизм глюкозы заканчивается на этапе пирувата, что сопровождается снижением выработки энергии примерно в 20 раз. Кроме того, формируется метаболический ацидоз, приводящий к повышению внутриклеточной концентрации ионов кальция и натрия. Усугубляет ситуацию конкурентное окисление жирных кислот в условиях ишемии, исходом которого являются внутриклеточный ацидоз и еще большее накопление натрия и кальция. Возникающие метаболические нарушения в конечном счете приводят к снижению сократимости миокарда и дальнейшему прогрессированию заболевания [4, 6].
Первые попытки оптимизации метаболизма миокарда при ИБС были сделаны более 50 лет назад. Препаратами, призванными улучшить состояние энергообмена миокарда при заболеваниях сердечно-сосудистой системы, стали средства, способствующие потреблению и анаболизму макроэргических соединений (АTФ). Традиционно в данную группу включают витамины группы В (особенно B1, B6, B12 и др.), инозин и инозит (который также считается витамином группы B). Также ранее использовался препарат трифосаденин, оказывающий цитопротективное действие и улучшающий мозговое и коронарное кровообращение [4]. На определенном этапе развития медицинской науки эти препараты были достаточно известны и широко использовались в клинической практике, однако опыт их клинического применения не содержит доказательной базы эффективности такой терапии.
В середине 1980-х гг. был разработан препарат триметазидин, принципиальной особенностью которого является прямое воздействие на ишемизированный миокард, приводящее к более рациональному использованию поступающего кислорода [7].
Триметазидин легко проникает через клеточные мембраны, т. к. находится в неионизированном состоянии при физиологических значениях рН. Биодоступность триметазидина – 90%: после приема внутрь он практически полностью абсорбируется из желудочно-кишечного тракта, легко проникает через гистогематические барьеры, связь с белками плазмы крови – 16%, выводится почками (около 60% – в неизмененном виде). Триметазидин блокирует окисление свободных жирных кислот (СЖК), подавляя активность 3-кетоацил-КоА-тиолазы, тем самым уменьшает образование ацетил-КоА и НАД-Н, способствует разблокированию пируватдегидрогеназы и переключению энергетического метаболизма миокарда на утилизацию глюкозы путем более «рентабельного» получения энергии – гликолиза (анаэробное расщепление глюкозы в цикле Кребса) [5, 8]. Избыток СЖК, поступающих в кардиомиоциты, в этих условиях направляется на синтез фосфолипидов, что обусловливает мембранопро-текторные свойства триметазидина. Триметазидин модифицированного высвобождения – единственный миокардиальный цитопротектор, имеющий достаточную доказательную базу для использования в качествеантиангинального средства.
Основные метаболические эффекты триметазидина включают:
- угнетение окисления СЖК;
- усиление окисления глюкозы и повышение синтеза АТФ;
- нормализацию трансмембранных ионных потоков;
- уменьшение образования свободных радикалов, недоокисленных продуктов обмена;
- уменьшение внутриклеточного ацидоза.
Доказанное свойство триметазидина оказывать положительное действие на уменьшение образования свободных радикалов – недоокисленных продуктов обмена, регулировать активность ключевого этапа энергетического метаболизма миокарда β-окисления СЖК, а также способность триметазидина улучшать обмен мембранных фосфолипидов, снижать пассивную проницаемость мембран и повышать их устойчивость к гипоксическому повреждению в условиях гибернации миокарда проявляется в усилении действия пролонгированных нитратов [5].
Триметазидин рекомендован Европейским обществом кардиологов (ЕОК) в 1997 г. в качестве препарата для метаболической терапии при стабильной стенокардии напряжения, эти рекомендации ЕОК подтверждены в 2006 и 2013 гг. [6].
Триметазидин модифицированного высвобождения – единственный миокардиальный цитопротектор, имеющий достаточную доказательную базу для использования в качестве антиангинального средства. Триметазидин MB может быть назначен на любом этапе терапии стабильной стенокардии для усиления антиангинальной эффективности БАБ, АК и нитратов, а также в качестве альтернативы при их непереносимости или противопоказаниях к применению [7].
Важным вопросом при лечении больных ИБС является выбор дозирования препарата, режим и длительность его приема. Эра триметазидинов начиналась с дозировки 20 мг, которая применялась 3 р/сут, что было неудобно пациенту. Затем появилась пролонгированная форма МВ 35 мг, которая позволила сократить количество приемов триметазидина до 2 р/сут, что повысило эффективность терапии стенокардии. Результаты метаанализа 21 клинического исследования (КИ) применения триметазидина с различными торговыми названиями у больных стабильной стенокардией II–III функционального класса (ФК) (по базам данных научных медицинских статей Elibrary, PubMed, GoogleScholar и др.) показали, что в 14 (66,7%) исследованиях триметазидин применялся в суточной дозе 70 мг, при этом в 12 КИ из 14 – в дозе по 35 мг 2 р/сут. Данные этого метаанализа позволяют рассматривать суточную дозу триметазидина 70 мг как стандартную терапевтическую при лечении больных ИБС.
В 2013 г. появился инновационный препарат Депренорм® МВ 70 мг. Теперь необходимую суточную дозу, которая введена во все стандарты терапии ИБС, можно применять однократно в сутки.
Депренорм® МВ 70 мг (триметазидин) производится ЗАО «Канонфармапродакшн» – современной компанией новой генерации российских производителей, строящих свой бизнес в соответствии с передовыми тенденциями развития фармацевтического рынка, отвечающими современным стандартам качества. В производстве препарата Депренорм® МВ 70 используется оригинальная матрица модифицированного высвобождения, которая получила Евразийский патент No009810, изготовленная из оптимально подобранных количеств гидрофобных и гидрофильных производных эфиров целлюлозы и производного поливинилпирролидона (коповидона), что позволяет обеспечить пролонгированное высвобождение препарата и стабильно поддерживать эффективную концентрацию в плазме крови в течение суток, а также не превышать рекомендованную суточную дозу – 70 мг. Известно также, что использование коповидонов значительно улучшает биодоступность препарата.
С помощью метода математического моделирования показано, что прием препарата Депренорм® МВ 70 мг 1 р/сут уменьшает кратность снижения концентрации действующего вещества в плазме крови до 1 р/сут вместо 2 р/сут (каждые 12 ч) в случае с препаратом сравнения (триметазидин 35 мг 2 р/сут). Поэтому с фармакологической точки зрения однократное применение препарата Депренорм® МВ 70 мг, содержащего стандартную суточную дозу триметазидина, будет способствовать более выраженному клиническому эффекту по сравнению с приемом триметазидина 35 мг 2 р/сут и достижению высокой комплаентности у больных ИБС [5]. Депренорм® МВ позволяет избежать таких проблем, как утреннее снижение антиишемического эффекта препарата, принятого накануне вечером, и, соответственно, снизить риск приступа стенокардии или инфаркта миокарда.
В связи с вышесказанным нам было интересно оценить клиническую эффективность инновационного отечественного триметазидина, применяемого 1 р/сут, Депренорм® МВ 70 мг в комплексной терапии с пролонгированными нитратами [9].
В середине 1980-х гг. был разработан препарат триметазидин, принципиальной особенностью которого является прямое воздействие на ишемизированный миокард, приводящее к более рациональному использованию поступающего кислорода.
В доступной литературе опубликовано достаточно большое количество работ, посвященных усилению эффективности действия основных антиангинальных препаратов (нитратов, БАБ и АК) при лечении стабильной стенокардии в сочетании с триметазидином. Однако, с какими именно группами наиболее выражен этот эффект, не ясно. В последние годы активно обсуждается роль окислительного стресса в патогенезе различных форм ИБС. Окислительный стресс проявляется нарушением баланса в системе «прооксидант – антиоксидант» в сторону прооксиданта [5]. Вовлечение активных форм кислорода (прооксиданты) в метаболические реакции в условиях недостаточности эндогенной антиокислительной системы (АОС) организма оказывает прямое действие на кардиомиоциты, способствует аритмогенной активности миокарда, активирует прокоагулянтную систему крови, ускоряет деградацию эндотелиального оксида азота, обеспечивающего вазодилатацию, и снижает антиангинальную эффективность нитратов [5, 6, 10]. Патофизиологическими факторами окислительного стресса является гипоксия (ишемия), воспалительная и стрессорная реакция [5]. В связи с этим антиоксидантная коррекция окислительного стресса у больных ИБС представляется очень перспективным направлением в лечении ИБС.
Цель работы: изучить возможность усиления антиангинальной эффективности пролонгированных нитратов и уменьшения окислительного стресса у больных стабильной стенокардией при их комплексном применении с триметазидином.
Материал и методы исследования
В рандомизированное плацебо-контролируемое исследование включено 85 пациентов в возрасте 52–66 лет с ИБС, стабильной стенокардией напряжения II–III ФК, длительно (более 6 мес.) принимающих пролонгированные препараты нитроглицерина (3–4 р/сут).
Критериями включения в исследование являлись: возраст больных до 70 лет, наличие стенокардии напряжения II–III ФК и имеющих противопоказания для назначения БАБ, согласие на участие в исследовании.
Критерии исключения из исследования: наличие гемодинамически и клинически значимого клапанного порока сердца, наличие иной клинически значимой патологии, способной повлиять на результаты исследования, противопоказаний к приему нитратов. Все больные получали статины, дезагреганты и ингибиторы ангиотензинпревращающего фермента (иАПФ). В качестве основных антиангинальных препаратов назначались нитраты. При наличии признаков хронической сердечной недостаточности (ХСН) пациенты получали дополнительно сердечные гликозиды и диуретики.
Пациенты были разделены на 2 группы методом простой рандомизации. Пациенты основной группы I (n = 48) на фоне продолжающейся в прежних дозах терапии нитратами в течение 6 мес. принимали триметазидин (Депренорм® МВ 70, ЗАО «Канонфармапродакшн») в суточной дозе 70 мг 1 р/сут. В контрольную группу II входили 37 больных, принимавших плацебо. Методы обследования включали оценку физической толерантности больного (нагрузочная проба) и выраженности окислительного стресса, которую оценивали по коэффициенту К. Для расчета коэффициента К в сыворотке определяли показатели перекисного окисления липидов (ПОЛ): содержание первичных (диеновые конъюгаты – ДК), вторичных (малоновый диальдегид – МДА) продуктов окисления. Определялись показатели АОС организма: концентрация основного липидного эндогенного антиоксиданта α-токоферола (ТФ) и внеклеточного антиоксидантного фермента церулоплазмина (ЦП).
У всех больных на фоне приема постоянной суточной дозы пролонгированных нитратов, статинов, иАПФ и дезагрегантов, традиционного образа жизни и неизменной физической активности методом парных велоэргометрий оценивали физическую толерантность с расчетом пороговой мощности (ПМ) и объема выполненной работы (ВР) на последнем этапе нагрузки, учитывали суточную частоту ангинозных приступов, число потребляемых в неделю таблеток нитроглицерина. Исходно, через 1 и 6 мес. лечения проводилось суточное холтеровское мониторирование с оценкой частоты, продолжительности периодов ишемии и суммарного интеграла смещения сегмента SТ, а также отношение суточного количества болевых/безболевых периодов ишемии.
Статистический анализ проводили при помощи программы Statistica 6.0 для Windows. Данные представлены в виде средних арифметических значений и ошибки среднего (M ± m). Критический уровень доверительности нулевой статистической гипотезы (об отсутствии различий) был принят равным 0,05. Достоверность значений оценивали по t-критерию Стьюдента для независимых выборок. Для оценки корреляционной взаимосвязи применяли метод Спирмена. Качественные, дискретные количественные при ненормальном распределении величины оценивали методами непараметрической статистики Майн – Уитни, Х [2].
Результаты и обсуждение
По основным клинико-демографическим характеристикам группы были сопоставимы между собой (табл. 1). Обращала на себя внимание высокая частота курения и артериальной гипертонии. В обеих группах наиболее часто определялся II ФК ХСН. Исследование закончили все пациенты обеих групп. Частота побочных эффектов в обеих группах была одинакова и была представлена в основном наличием головной боли.
Как видно из данных, представленных в таблице 2, у больных ИБС и стабильной стенокардией отмечалась интенсификация процессов ПОЛ (нарастание в плазме крови ДК и МДА) и недостаточность эндогенной АОС (увеличение коэффициента К, повышение активности ТФ и ЦП).
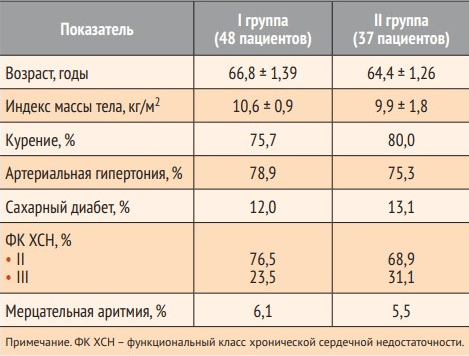
Таблица 1. Исходная клинико-демографическая характеристика пациентов.
Динамика параметров физической толерантности и степени ишемии миокарда больных, отмеченная в ходе исследования, представлена в таблице 3. Исходно на фоне антиангинальной терапии нитратами как в основной, так и в контрольной группе выявлена сниженная толерантность к физической нагрузке (ПМ – 77,6 ± 6,99 Вт и 78,7 ± 5,1 Вт соответственно). При этом в основной и контрольной группах отмечено 9,16 ± 0,48 и 10,7 ± 0,50 эпизода ишемии в сутки соответственно, продолжительностью 867,3 ± 32,10 и 939,7 ± 18,2 с/сут. Суммарный интеграл смещения сегмента SТ составил соответственно: 217,4 ± 5,18 и 221,4 ± 6,9 мВ с/сут. Отношение болевых/ безболевых периодов ишемии в сутки в основной группе составило 1,86 ± 0,16, в контрольной – 1,87 ± 0,15. Полученные результаты свидетельствовали о недостаточной анти ангинальной эффективности потребляемых больными пролонгированных нитратов.
Анализ результатов исследования показал, что в основной группе больных наблюдалось статистически значимое повышение ПМ: через 1 мес. – на 41,3%, через 6 мес. – на 63,4% (р < 0,05 в сравнении с исходным уровнем и при сравнении с контрольной группой по критерию χ2). Объем ВР на последнем этапе в основной группе также увеличился: через 1 мес. лечения – на 54,2%, через 6 мес. – на 91,0%. На фоне комбинированной терапии в основной группе отмечено уменьшение частоты (на 39,6% через 1 мес., на 55,4% через 6 мес.), продолжительности (на 57 и 67,8% соответственно) периодов ишемии при холтеровском мониторировании ЭКГ (табл. 3). В результате 6-месячной терапии в основной группе соотношение числа болевых и безболевых периодов ишемии существенно уменьшилось (на 24,0%; р < 0,05 по критерию χ2) и составило 1,33 ± 0,04. В контрольной группе значение указанного параметра не изменилось (1,80 ± 0,22). За период лечения в основной группе сократилась величина суммарного интеграла депрессии SТ за сутки (на 67,1%). В основной группе также сократилось количество потребляемых больными таблеток нитроглицерина в неделю: через 1 мес. – с 10,7 ± 0,39 до 5,18 ± 0,20 (р < 0,05), через 6 мес. – до 2,19 ± 0,27 табл. (р < 0,05).
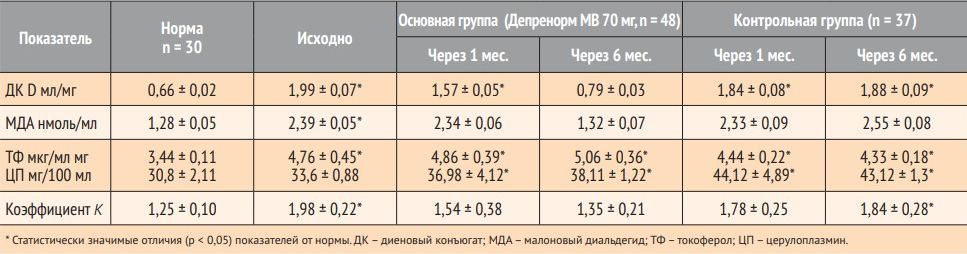
Таблица 2. Показатели параметров свободнорадикального окисления липидов крови больных ИБС и стабильной стенокардией напряжения II–III ФК
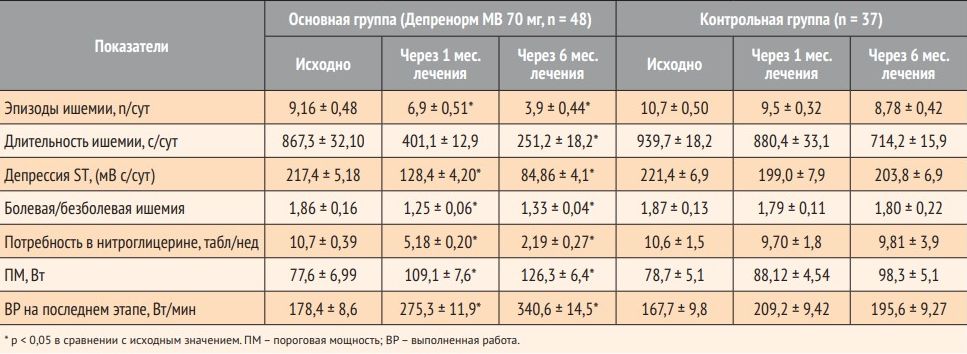
Таблица 3. Динамика параметров физической толерантности и степени ишемии миокарда больных ИБС на фоне терапии в исследуемых группах
Полученные результаты свидетельствуют о сокращении глубины и продолжительности ишемии на фоне приема препарата Депренорм® МВ 70 у больных стабильной стенокардией. Прием плацебо не отразился на величине исследуемых показателей.
Согласно данным, представленным в таблице 2, у всех больных в контрольной и основной группах при поступлении наблюдалось значительное повышение уровня первичных (ДК) и вторичных (МДА) продуктов ПОЛ. В последующие сроки наблюдения у больных контрольной группы концентрация ДК возрастает в еще большей степени, как и содержание МДА. Депренорм® МВ 70 мг достоверно снижал ДК и МДА, т. е. снижал выраженность процессов ПОЛ в составе комплексной терапии пациентов основной группы.
Исследование динамики показателей АОС организма показало, что у больных обеих групп наблюдалось достоверное повышение
по
сравнению с нормой основных эндогенных липидных антиоксидантов – ТФ и ЦП, при этом степень снижения их содержания была
достоверно более выражена в группе больных, получавших Депренорм® МВ 70 мг.
При длительном применении нитратов довольно быстро развивается резистентность к проводимой терапии и увеличение дозы
препарата при этом существенно ситуацию не изменяет. По современным взглядам, пролонгируемые нитраты оказывают свой
вазодилатирующий эффект за счет образовавшегося под их действием экзогенного оксида азота, который вырабатывается
эндотелием и затем обеспечивает релаксацию сосудов [1, 4, 11–13]. Также хорошо известно, что при ИБС развитие
резистентности к нитратам и нарушение тонуса сосудов связаны с активацией процессов свободнорадикального окисления,
приводящих к снижению активности антиоксидантных ферментов. Способность триметазидина уменьшать образование свободных
радикалов, недоокисленных продуктов обмена, а также регулировать ключевой этап энергетического метаболизма миокарда –
β-окисления СЖК объясняет усиление антиангинальной эффективности пролонгируемых нитратов у больных стабильной
стенокардией, принимающих Депренорм® МВ 70 мг.
Заключение
Назначение инновационного препарата Депренорм® МВ 70 для однократного приема в сутки у больных ИБС и стабильной стенокардией напряжения, принимающих пролонгированные нитраты, увеличивает физическую толерантность, уменьшает ФК стенокардии и предотвращает развитие резистентности к терапии. Депренорм® МВ 70 уменьшает выраженность окислительного стресса у больных ИБС, что проявляется снижением процессов ПОЛ и повышением компенсаторных возможностей эндогенной антиоксидантной системы.
Депренорм® МВ 70 улучшает клиническое течение стенокардии и повышает антиангинальную эффективность пролонгированных нитратов при их длительном применении.