Содержание
Резюме
Легочная артериальная гипертензия (ЛАГ) — жизнеугрожающее сердечно-сосудистое заболевание, которое характеризуется выраженным повышением легочного сосудистого сопротивления и давления в легочной артерии вследствие обструктивного ремоделирования легочного сосудистого русла с развитием правожелудочковой сердечной недостаточности как причины преждевременной смертности. Нарушение синтеза и снижение биодоступности оксида азота представляет собой один из ключевых патофизиологических механизмов развития и прогрессирования заболевания.
В обзорной статье представлены ключевые данные доказательной базы по клиническому применению тадалафила – ингибитора фосфодиэстеразы типа 5 (ИФДЭ5), который в августе 2023 г. одобрен Фармкомитетом Минздрава России по показанию — лечение пациентов с ЛАГ.
Тадакардил Канон компании Канонфарма Продакшн является первым и единственным на сегодняшний день в российской практике лекарственным препаратом с действующим веществом тадалафил с зарегистрированным показанием «ЛАГ», одобренным в Евразийских рекомендациях по диагностике и лечению легочной гипертензии 2023г. и доступным на территории РФ и ЕАЭС.
Тадакардил Канон показан к применению у взрослых пациентов с ЛАГ функционального класса II и III по классификации ВОЗ для повышения толерантности к физическим нагрузкам. Эффективность тадалафила показана при идиопатической ЛАГ и ЛАГ, связанной с заболеваниями соединительной ткани. Рекомендуемая доза составляет 40 мг (2 таблетки по 20 мг) один раз в сутки. В статье описаны механизм действия и фармакологические эффекты ингибиторов фосфодиэстеразы типа 5 (ИФДЭ5), особенности фармакокинетики тадалафила в сравнении с другими препаратами класса.
Преимуществами препарата Тадакардила Канон компании Канонфарма Продакшн являются доказанная эффективность применения у пациентов с ЛАГ, удобство в применении, обусловленное однократным приёмом в стандартной дозе 2 таблетки по 20 мг один раз в день; хорошая переносимость и благоприятный профиль безопасности; доказанная биоэквивалентность референтному препарату. В свете новых Евразийских рекомендаций по диагностике и лечению ЛГ тадалафил имеет широкое поле для клинического применения, что позволит улучшить возможности лечения пациентов с ЛАГ как в режиме моно-, так и комбинированной терапии.
Ключевые слова: легочная артериальная гипертензия, ЛАГ-специфические препараты, ингибиторы фосфодиэстеразы типа 5, тадалафил.
Конфликт интересов: Автор статьи Мартынюк Т.В. является членом редакционного совета журнала «Евразийский Кардиологический Журнал», но не имеет никакого отношения к решению опубликовать эту статью. Статья прошла принятую в журнале процедуру рецензирования. Об иных конфликтах интересов автор не заявлял. Финансирование. Статья подготовлена при финансовой поддержке компании Канонфарма Продакшн.
Для цитирования: Мартынюк Т.В. Место тадалафила в терапии ЛАГ в свете новых клинических рекомендаций Евразийской Ассоциации Кардиологов. Евразийский кардиологический журнал. Февраль 2024;(1):92-99. https://doi.org/10.38109/2225-1685-2024-1-92-99.
Мартынюк Тамила Витальевна, д.м.н., руководитель отдела легочной гипертензии и заболеваний сердца, институт клинической кардиологии им. А.Л. Мясникова, ФГБУ «НМИЦ кардиологии им. акад. Е.И. Чазова» Минздрава России; профессор кафедры кардиологии, факультет дополнительного профессионального образования, РНИМУ им. Н.И. Пирогова, ул. Академика Чазова, д. 15 А, г. Москва 121552, Российская Федерация, e-mail: trukhiniv@mail.ru, ORCID: 0000-0002-9022-8097.
Современная патогенетическая терапия позволила существенно улучшить прогноз пациентов с легочной артериальной гипертензией (ЛАГ) — жизнеугрожающего сердечно-сосудистого заболевания, которое характеризуется выраженным повышением легочного сосудистого сопротивления (ЛСС) и давления в легочной артерии вследствие обструктивного ремоделирования легочного сосудистого русла с развитием правожелудочковой сердечной недостаточности как причины преждевременной смертности [1-3].
В 2022 г. Европейским обществом кардиологов (ESC) и Европейским респираторным обществом (ERS) по диагностике и лечению легочной гипертензии (ЛГ) предложен новый диагностический критерий — повышение среднего давления в легочной артерии (срДЛА) >20 мм рт. ст. в покое по данным катетеризации правых отделов сердца (КПОС) [2]. ЛАГ является прекапиллярной формой ЛГ при отсутствии заболеваний легких, хронической тромбоэмболии в систему легочной артерии, других редких болезней как возможных причин повышения давления в легочной артерии (ДЛА) [2]. Новые диагностические критерии ЛАГ — срДЛА >20 мм рт. ст., давление заклинивания в легочной артерии ≤15 мм рт. ст., ЛСС >2 ЕД Вуда, приняты и в новых Евразийских рекомендациях по диагностике и лечению ЛГ 2023 г.
В сложном патогенезе ЛАГ важную роль играет эндотелиальная дисфункция, при которой бурная пролиферация сосудистых клеток в условиях подавленного апоптоза, воспалительный процесс, вазоконстрикция и тромбоз in situ способствуют сужению или облитерации мелких легочных артерий и артериол и повышению сопротивления легочных сосудов [4]. Патофизиологической основой указанных процессов выступает дисбаланс вазоактивных веществ, обладающих пролиферативным и воспалительным потенциалом — гиперпродукция вазоконстрикторных (эндотелин-1, тромбоксан А2, серотонин) и снижение синтеза вазодилатирующих медиаторов (оксид азота (NO), простациклин [1-7]. Ремоделирование легочных сосудов является результатом пролиферации эндотелия, гладкомышечных клеток, фибробластов вследствие патологической активации факторов транскрипции в условиях нарушения процессов митохондриального дыхания с усилением энергетической зависимости от аэробного гликолиза [6]. Патологический процесс захватывает и адвентицию, в которой отмечается повышенная продукция внеклеточного матриксаколлагена, эластина, фибронектина и тенасцина [2,4].
Нарушение синтеза и снижение биодоступности NО представляет собой один из ключевых патофизиологических механизмов развития и прогрессирования ЛАГ [1-7]. При иммуногистохимических исследованиях в клетках эндотелия легочных сосудов больных с идиопатической ЛГ (ИЛГ) показано снижение экспрессии эндотелиальной NO-синтазы (eNOS) [8]. Продукция NO определяется множеством факторов таких, как экспрессия гена NO-синтазы, активность NO-синтазы и фосфодиэстераз (ФДЭ), обеспечивающих регуляцию продукции циклинического гуанозинмонофосфата (цГМФ) и его постсинтетического окисления [1-10].
На разных исторических этапах для лечения пациентов с ЛАГ применялись ингаляционный NO, субстрат для его синтеза — L-аргинин, а также препараты, способствующие продукции цГМФ. В результате комплекса экспериментальных и клинических исследований при ЛАГ ингибиторы ФДЭ типа 5 (ИФДЭ5) стали первым классом пероральной патогенетической терапии с воздействием на сигнальный путь NO, доказавшим положительный эффект на ремоделирование легочных сосудов, функциональный статус и показатели легочной гемодинамики у этой категории пациентов [1,3,5-7,11]. Силденафила цитрат явился первым препаратом класса ИФДЭ5, который в 2005г. был одобрен Администрацией по контролю качества продуктов питания и лекарственных средств (FDA) для лечения больных ЛАГ с функциональным классом (ФК) II–IV (ВОЗ) с целью улучшения переносимости физических нагрузок в дозе 20 мг 2 3 раза в сутки [2,5]. В 2009 г. для лечения больных ЛАГ с ФК II-IV (ВОЗ) за рубежом был одобрен тадалафил 20-40 мг 1 раз/сутки [2,5].
В российской практике на протяжении многих лет, начиная с 2011 г., единственным ИФДЭ5, одобренным Фармкомитетом Минздрава России для лечения больных с ЛАГ, был силденафила цитрат [1,3,6,7]. В августе 2023 г. Фармкомитетом Минздрава России одобрен тадалафил компании Канонфарма Продакшн (Тадакардил Канон, Россия) как первый и единственный в РФ с показанием — лечение пациентов с ЛАГ [12].
Тадакардил Канон показан к применению у взрослых пациентов с ЛАГ ФК II и III по классификации ВОЗ для повышения толерантности к физическим нагрузкам. Эффективность тадалафила была показана при ИЛГ и при ЛАГ, связанной с заболеваниями соединительной ткани. Рекомендуемая доза составляет 40 мг (2 таблетки по 20 мг) один раз в сутки [12].
Механизм действия и фармакологические эффекты
ИФДЭ5 — селективные ингибиторы цГМФ-зависимой ФДЭ типа 5 (ФДЭ-5), вызывая селективную деградацию цГМФ с его инактивацией, способствуют повышению внутриклеточного содержания цГМФ как второго мессенджера эндогенного NO [1,3,5-7]. Таким образом, цГМФ рассматривается как молекула-мишень при ЛАГ [9,11]. Тадалафил, как мощный селективный ИФДЭ5, за счёт блокады ФДЭ-5 повышает концентрацию цГМФ, что приводит к расслаблению гладкомышечных клеток легочных сосудов и вазодилатации легочного сосудистого русла [5,12,13].
Продукция цГМФ осуществляется под действием оксида азота, который стимулирует растворимую гуанилатциклазу или под влиянием натрийуретических пептидов (предсердного и мозгового), активирующих фермент через натрийуретические рецепторы [1,3]. Вазодилатирующий эффект NO зависит от его способности увеличивать и поддерживать концентрацию цГМФ в гладкомышечных клетках. NO активирует гианилатциклазу, что способствует повышению продукции цГМФ и вазорелаксации. Этот эффект является непродолжительным из-за быстрого разрушения цГМФ посредством ФДЭ. ФДЭ-5 осуществляет гидролиз циклинического аденозинмонофосфата и цГМФ, ограничивая их внутриклеточные эффекты. ИФДЭ5 усиливают или продлевают вазодилататорное и антипролиферативное действие этих циклических нуклеотидов [9,14].
Изоферменты ФДЭ представлены в органах и тканях различным образом. ФДЭ-5 локализуется, главным образом, в легких, его активность крайне высока в легочных сосудах, что подтверждается данными экспериментальных исследований [10].
Блокада ФДЭ-5 оказывает вазодилатирующий эффект, способствует уменьшению синтеза ДНК и пролиферации гладкомышечных клеток, усилению процессов апоптоза клеток, что в совокупности приводит к регрессу ремоделирования легочных сосудов.
Основные эффекты:
• Вазодилатация реализуется за счёт расслабления гладкомышечных клеток легочных сосудов и калиевых каналов под
действием
цГМФ
• Антипролиферативный эффект обеспечивается за счёт активации цГМФ-зависимых пептидных киназ [14].
Фармакокинетика
Силденафил, тадалафил и варденафил, одобренные для лечения эректильной дисфункции, являясь селективными ИФДЭ5, демонстрируют различные фармакокинетические особенности и селективность в отношении различных изоферментов ФДЭ. Все три ИФДЭ5 вызывают дилатацию легочных сосудов с достижением максимального эффекта через 60, 75- 90 и 40-45 минут соответственно [5]. ИФДЭ5 при назначении внутрь быстро всасываются, связывание с белками плазмы крови составляет 94-96%. Скорость достижения максимальной концентрации в плазме крови различается (табл. 1).
Тадалафил — пероральный ИФДЭ5 с наибольшим периодом полувыведения, что позволяет назначать препарат один раз в сутки [5,9]. Период полужизни тадалафила достигает до 17,5 часов, в то время как для силденафила и варденафила — лишь 4-5 часов. Равновесная концентрация тадалафила достигается на 5-й день при ежедневном приеме и превышает первоначальную в 1,6 раза, поэтому препарат не обладает способностью к кумуляции [12]. Биодоступность силденафила составляет 41%, варденафила — 15%. Биодоступность тадалафила (85%) вычислялась только косвенным путем, так как активное вещество не растворяется в воде и не может вводиться внутривенно.
После приема внутрь тадалафил быстро всасывается с достижением средней максимальной концентрации (Cmax) в плазме крови примерно через 4 часа. Скорость и степень всасывания тадалафила не зависят от времени приема пищи, поэтому тадалафил можно применять вне зависимости от приёма пищи. Время приёма (утром или вечером) не оказывало клинически значимого влияния на скорость и степень всасывания [3]. Одновременный прием жирной пищи уменьшает и задерживает всасывание силденафила. Скорость и полнота всасывания варденафила также зависят от жирности пищи: если содержание жиров превышает 57%, они уменьшаются, а если содержание жиров не превышает 30% — не изменяются [3].
Максимальная концентрация тадалафила в плазме достигается в среднем через 2 часа после приёма препарата. Средний объем распределения в равновесной концентрации составляет приблизительно 77 л, что указывает на то, что тадалафил распределяется в тканях организма.
Тадалафил в основном метаболизируется изоферментом CYP3A4 цитохрома P450. Основным циркулирующим метаболитом является метилкатехолглюкуронид, который в 13000 раз менее активен в отношении ФДЭ-5, чем тадалафил. Тадалафил выводится преимущественно в виде неактивных метаболитов, главным образом с калом (приблизительно 61% дозы) и в меньшей степени с мочой (приблизительно 36% дозы).
Назначение тадалафила не рекомендуется пациентам, постоянно принимающим мощные индукторы CYP3A4, такие как рифампицин. Для пациентов, принимающих одновременно мощные ингибиторы CYP3A4, такие как кетоконазол или ритонавир, применение тадалафила не рекомендуется [12,13]. У пациентов, получающих ингибиторы протеазы, сообщалось о межлекарственном взаимодействии с ИФДЭ5 со значительным повышением концентраций последних [15,16]. Силденафил и тадалафил следует назначать в низких дозах с тщательным контролем потенциальных побочных эффектов, включая гипотонию. Совместный прием бозентана с тадалафилом сопровождается снижением концентрации иФДЭ-5 типа в крови, что может снижать эффективность подобных комбинаций [17].
Таблица 1. Сравнительный анализ фармакокинетики ингибиторов фосфодиэстеразы типа 5 [3]
Доказательная база по клиническому применению Тадалафила
При изучении тадалафила у пациентов с ЛАГ регистрационнымявилось рандомизированное двойное слепое плацебо-контролируемое исследование PHIRST (Randomized, Double-Blind, Placebo-Controlled Phase 3 Study of the Phosphodiesterase Type 5 Inhibitor Tadalafil in the Treatment in Patients With Pulmonary Arterial Hypertension). Целью исследования было изучение эффективности и безопасности тадалафила в различных дозовых режимаха (5, 10, 20 и 40 мг один раз в день) в сравнении с плацебо [5,18]. В задачи входила оценка влияния тадалафила/ плацебо на клиническую симптоматику, толерантность к физическим нагрузкам, гемодинамические параметры, время до развития клинического ухудшения у 406 больных с ЛАГ.
Критериями включения были возраст не менее 12 лет, верифицированный диагноз ЛАГ (ИЛГ, ЛАГ вследствие заболеваний соединительной ткани или приёма аноректиков, ВИЧ-инфекции, после хирургической коррекции врожденных пороков сердца – системно-легочных шунтов (дефект межпредсердной перегородки, дефект межжелудочковой перегородки, открытый артериальный проток) не менее 1 года назад [5,18]. Средний возраст пациентов составил 54 года (от 14 до 90 лет), большинство пациентов принадлежали к европеоидной расе (80,5%) и были женского пола (78,3%). При анализе этиологии ЛАГ преобладали пациенты с ИЛГ (61,0%) и ЛАГ, ассоциированной с заболеванием соединительной ткани (23,5%). У большинства пациентов отмечался ФК III (65,2%) или II (32,1%). Исходная дистанция в тесте 6-минутной ходьбы (Т6МХ) составила 343,6 м.
Фоновая терапия включала бозентан (стабильная поддерживающая доза до 125 мг два раза в день у 53,3%) пациентов), антикоагулянты, дигоксин, диуретики и кислород. Пациенты были рандомизированы в одну из пяти групп лечения (тадалафил 5, 10, 20 и 40 мг или плацебо). Первичной конечной точкой при оценке эффективности была динамика дистанции в Т6МХ по сравнению с исходной через 16 недель лечения.
При назначении тадалафила в дозе 40 мг плацебо-корригированная дистанция в Т6МХ достоверно увеличилась на 26 м
(р=0,0004; 95% доверительный интервал (ДИ): 9,5, 44,0). Причем тенденция к улучшению отмечалась уже через 8 недель
лечения. Достоверный прирост дистанции в Т6МХ наблюдался на 12 неделе (р<0,01), когда оценивалась фармакокинетика.
Полученные результаты не отличались в подгруппах лечения пациентов в зависимости от возраста, пола, этиологии ЛАГ,
исходного ФК и дистанции в Т6МХ. Интересно, что медиана плацебо-корригированной дистанции в подгрупппе талалафила с
дозой 40 мг у больных с предшествующей терапией бозентаном составила 17м (р=0,09; 95% ДИ: -7,1, 43,0), в то время
как при назначении тадалафила в дозе 40 мг ранее не леченным пациентам (n=37) +44 м (95% ДИ: 19,7, 69,0). Доля
пациентов с улучшением ФК (ВОЗ) к 16-й неделе была сопоставимой в группах тадалафила в дозе 40 мг и плацебо (23%
против 21%). Частота клинического ухудшения к 16 неделе у пациентов, получавших тадалафил в дозе 40 мг (5%; 4 из 79
пациентов), была меньше, чем в группе плацебо (16%; 13 из 82 пациентов).
Изменения индекса одышки по шкале Борга были незначимыми. Кроме того, при применении тадалафила в дозе 40 мг
наблюдалось улучшение по сравнению с плацебо ряда показателей качества жизни по опроснику SF-36 — физического и
ролевого функционирования, телесной боли, общего состояния здоровья, жизненной силы и социального функционирования
при
отсутствии значимой динамики показателей эмоционального состояния и психического здоровья. При применении тадалафила
в
дозе 40 мг по сравнению с плацебо достигалось достоверное улучшение и по Европейскому опроснику качества жизни
(EQ5D)
[18].
Профиль побочных эффектов при приеме тадалафила оказался сопоставимым с таковым при применении силденафила. Наиболее частыми нежелательными явлениями были головная боль и приливы [5,12,18].
В небольшом исследовании SITAR у 35 пациентов с ЛАГ перевод с силденафила на тадалафил сопровождался большей удовлетворенностью пациентов качеством лечения, что представляется целесообразным у пациентов с выраженными побочными эффектами на фоне терапии силденафила [19].
Новой страницей в изучении тадалафила явилось рандомизированное двойное слепое плацебо-контролируемое исследование
АMBITION (A Study of First-Line Ambrisentan and Tadalafil Combination Therapy in Subjects With Pulmonary Arterial
Hypertension), в котором препарат изучался в качестве компонента стартовой комбинированной терапии [20]. В
крупномасштабном проспективном двойном слепом исследовании 610 пациентов ЛАГ (преимущественно ИЛГ, наследственная ЛАГ,
ЛАГ при приеме лекарств/токсинов или вследствие заболеваний соединительной ткани), ранее не получавшие специфическую
терапию, с ФК II и III (ВОЗ) были рандомизированы в группы комбинированной терапии (амбризентан и тадалафил) или
монотерапии амбризентаном или тадалафилом. Первичной конечной точкой было время до первого события «клинической
неудачи» (случаи смерти, госпитализации в связи с ухудшением течения ЛАГ, прогрессирования заболевания и
неудовлетворительного клинического ответа в долгосрочной перспективе).
Результаты исследования АMBITION показали достоверную разницу между группами комбинированной и монотерапии
(объединенные группы монотерапии) для первичной конечной точки (p<0,01), что было обусловлено, главным образом,
снижением на 63% частоты госпитализации по поводу ухудшения ЛАГ (р=0,0002). В целом, комбинированная терапия
способствовала снижению риска клинической неудачи и на 50% (р=0,0002) при оптимальном профиле безопасности/
переносимости двойной терапии [20]. Отношение рисков (ОР) достижения первичной конечной точки в группе
комбинированной терапии по сравнению с объединенной группой монотерапии составило 0,50 (95% ДИ: 0,35–0,72; р<0,001).
На фоне проведения стартовой комбинированной терапии наблюдалось статистически достоверное увеличение дистанции в
Т6МХ, снижение концентрация NT-proBNP. Начальная комбинированная терапия амбризентаном и тадалафилом была связана с
более значительным улучшением показателей. гемодинамики и толерантности к физической нагрузке по сравнению с
монотерапией [20]. К финалу исследования умерли 10% пациентов в группе стартовой комбинированной терапии и 14%
пациентов в группах стартовой монотерапии (ОР 0,67; 95% ДИ: 0,42–1,08).
Таким образом, стартовая комбинированная терапия тадалафилом 40 мг и амбризентаном 10 мг приводила к снижению риска прогрессирования ЛАГ или недостаточного клинического ответа (смертность, прогрессирование/ госпитализация по причине ухудшения ЛАГ, неудовлетворительный долгосрочный клинический ответ) на 50% по сравнению с группами монотерапии амбризентаном 10 мг 1 р/сут. или тадалафилом в целевой дозе 40 мг 1 р/сут. (p< 0,001) [21].
В открытом рандомизированном исследовании OPTIMА были получены результаты в пользу эффективности стартовой двойной терапии, включающей тадалафил и мацитентан, которые перекликаются с полученными данными в исследовании AMBITION [22]. Среди 46 пациентов с впервые выявленной ЛАГ (ИЛГ, наследственная ЛАГ, ЛАГ при приеме лекарств/ токсинов или вследствие заболеваний соединительной ткани, резидуальная ЛАГ после коррекции врождённых пороков сердца) ФК II и III (ВОЗ) определялся у 21,7% и 78,3% больных соответственно, только 6,5% больных исходно имели 4 параметра низкого риска (ФК I–II (ВОЗ), дистанция в Т6МХ>440 м, среднее давление в правом предсердии <8 мм рт. ст., сердечный индекс ≥2,5л x мин-1 x м-2).
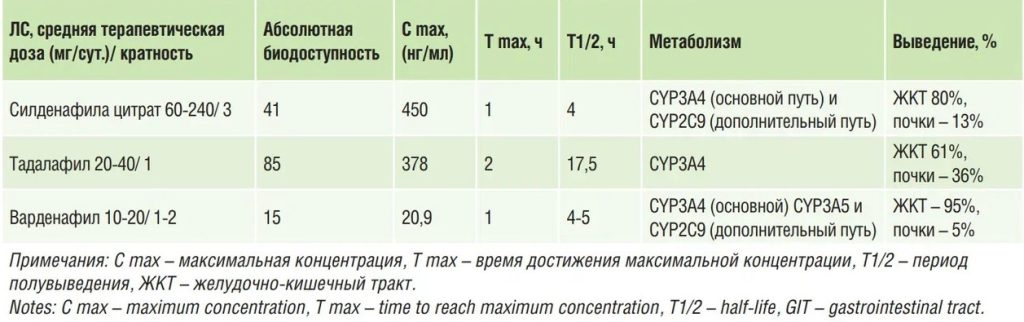
За 16 недель лечения тадалафилом в целевой дозе 40 мг 1 р/ день и мацитентаном 10 мг 1 р/ день 19,6% и 50% больных достигли ФК I и II (ВОЗ), улучшение ФК отмечено в 63% больных, у 73% больных увеличилось число вышеуказанных параметров низкого риска. Доли больных с тремя и 4-мя показателями низкого риска составили 34,8% и 17,4% соответственно. Ключевые результаты исследования представлены в таблице 2 [22].
Таблица 2. Результаты лечения пациентов с ЛАГ в исследовании OPTIMA [22]
Sitbon О. и соавт. в ретроспективном исследовании у 97 пациентов с впервые диагностированной ЛАГ (86% больных с ФК III-IV (ВОЗ)) изучали эффективность различных стартовых двойных схем, включавших ИФДЭ5 и антагонисты рецепторов эндотелина [23]. В реальной клинической практике больным назначались бозентан в сочетании с силденафилом (n=61) или тадалафилом (n=17), амбризентан в сочетании с тадалафилом (n=11) или силденафилом (n=8). Все режимы лечения приводили к значительному улучшению ФК и гемодинамических показателей через 4 месяца наблюдения. В течение среднего периода наблюдения 30 месяцев в живых остались 82% пациентов, 71% из них продолжили рекомендованную двойную пероральную терапию. Общая выживаемость составила 97%, 94% и 83% через 1, 2 и 3 года соответственно; у пациентов с ИЛГ, наследственной ЛАГ, ЛАГ при приеме аноректиков — 96%, 94% и 84% соответственно [23].
В рандомизированное двойное слепое плацебо-контролируемое исследование TRITON (The Efficacy and Safety of Initial Triple Versus Initial Dual Oral Combination Therapy in Patients With Newly Diagnosed Pulmonary Arterial Hypertension) включались пациенты с впервые установленной ЛАГ (ИЛГ/ наследственная ЛАГ/ ЛАГ на фоне приёма лекарств и токсинов/ ЛАГ, ассоциированная с заболеваниями соединительной ткани), которым назначалась стартовая двойная комбинированная терапия мацитентаном и тадалафилом (плюс плацебо) или стартовая тройная комбинированная терапия мацитентаном в дозе 10 мг 1 р/сут., тадалафилом в целевой дозе 40 мг 1 р/сут. и селексипагом в дозе до 1600 мкг 2 р/сут. [24]. К 26-й неделе ЛСС снизилось на 52% и 54% на фоне двойной или тройной комбинированной терапии, соответственно, а дистанция в Т6МХ увеличилась на 55 м и 56 м, соответственно. Средние геометрические значения отношения концентраций NT-proBNP к 26-й неделе относительно исходного уровня составили 0,25 и 0,26, соответственно. Таким образом, исследование TRITON не показало преимуществ стартовой пероральной тройной терапии по сравнению со стартовой пероральной двойной комбинированной терапией, однако подтвердило возможность существенного улучшения показателей гемодинамики и переносимости физической нагрузки при назначении стартовой двойной комбинированной при назначении стартовой двойной комбинированной терапии тадалафилом и мацитентаном у пациентов с ЛАГ [24]. Необходимы дальнейшие исследования для изучения влияния стартовой тройной пероральной ЛАГ терапии на долгосрочные исходы. В рекомендациях ESC/ERS 2022 г. впервые подчёркивается обоснованное применение стартовой комбинированной терапии тадалафила и амбризентана/мацитентана пациентам с ИЛГ/ наследственной ЛАГ/ ЛАГ при приёме лекарств/ токсинов/ ЛАГ вследствие заболеваний соединительной ткани низкого и промежуточного риска [2].
Тадалафил в педиатрической практике изучался в открытом рандомизированном исследовании у детей в возрасте старше трех лет, однако препарат не получил одобрения Европейского агентства по лекарственным средствам на применение у детей с ЛАГ. Обсуждаемые дозировки 0,5–1 мг/кг/сут. в один приём и максимальная суточная дозировка 40 мг/сут. [25,26].
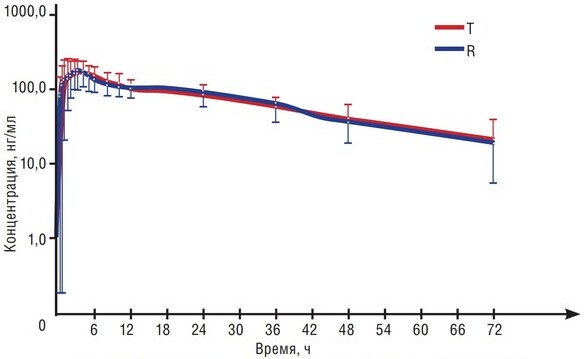
Рисунок 1. Тадакардил Канон полностью биоэквивалентен референтному оригинальному тадалафилу * [12]
Итак, преимуществами Тадакардила Канон, первого и единственного на сегодняшний день в российской практике
лекарственного препарата с действующим веществом тадалафил с зарегистрированным показанием «ЛАГ»,
доступным на
территории РФ и ЕАЭС, являются:
• Эффективность применения у пациентов с ЛАГ доказана [27].
• Удобство в применении, обусловленное однократным приёмом. Стандартная доза составляет 2 таблетки по 20
мг один
раз в день. Таблетки следует принимать одновременно [12].
• Хорошая переносимость и благоприятный профиль безопасности [2,14,27].
• Доказанная биоэквивалентность референтному препарату.
В открытом рандомизированном перекрестном двухэтапном исследовании сравнительной фармакокинетики и биоэквивалентности препаратов Тадакардил Канон (МНН: тадалафил), таблетки, покрытые пленочной оболочкой, 20 мг и препарата ADCIRCA® (МНН: тадалафил), film-coated tablets, 20 mg (Eli Lilly Nederland B.V., Netherlands) у здоровых добровольцев при приеме натощак показана полная биэквивалентность препаратов.
В свете новых Евразийских рекомендаций по диагностике и лечению ЛГ тадалафил (Тадакардил Канон) имеет широкое поле для клинического применения, что позволит улучшить возможности лечения пациентов с ЛАГ. Так, в режиме монотерапии препарат показан для лечения пациентов с ИЛГ, наследственной ЛАГ, ЛАГ при приёме лекарств/токсинов в случае отрицательного теста на вазореактивность; при ЛАГ вследствие заболеваний соединительной ткани и резидуальной ЛАГ после коррекции простых системно-легочных шунтов при отсутствии значимой коморбидности и установленном низком риске, а также при наличии сопутствующих заболеваний левых отделов сердца или лёгких независимо от исходного профиля риска. Пациентам с ИЛГ, наследственной ЛАГ, ЛАГ при приёме лекарств/токсинов, ЛАГ, ассоциированной с заболеваниями соединительной ткани, резидуальной ЛАГ после коррекции простых системно-лёгочных шунтов промежуточного риска без сопутствующей сердечно-лёгочной коморбидности назначение мацитентана и тадалафила рекомендуются в качестве начальной пероральной терапии [2]. Следует рассматривать назначение тадалафила и в схемах последовательной комбинированной терапии. В частности, возможно рассмотреть добавление тадалафила к бозентану у пациентов с ИЛГ, наследственной ЛАГ, ЛАГ при приёме лекарств/токсинов для улучшения переносимости физических нагрузок [2].
