Содержание
Резюме
Сердечно-сосудистые заболевания, в первую очередь ишемическая болезнь сердца, являются основной причиной инвалидизации; уровень ежегодной смертности таких пациентов, по данным различных регистров, составляет 2–3%. Это объясняет интерес практических врачей к вопросам фармакотерапии стабильных форм ИБС с позиций современных знаний о патогенезе заболевания и приверженности лечению. Особенности патогенеза ИБС в виде повышенной потребности миокарда в кислороде, повышения пред- и постнагрузки на сердце диктуют необходимость назначения ритмоурежающих ЛС – бетаадреноблокаторов, блокаторов кальциевых каналов, ивабрадина или их комбинаций, а также нитросодержащих препаратов; с целью миокардиальной цитопротекции – триметазидин, ранолазин. Однако использование препаратов гемодинамического действия (бета-адреноблокаторы, блокаторы кальциевых каналов) не всегда эффективно контролирует симптомы стенокардии даже при применении их в комбинации. Это диктует необходимость совершенствования медикаментозного воздействия на ишемизированный миокард с учетом нарушений, происходящих в метаболизме кардиомиоцитов при гипоксии. В связи с этим применение триметазидина на начальных этапах ишемии – на уровне нарушения метаболизма не позволяет развиваться более поздним осложнениям: нарушениям сократительной функции кардиомиоцитов и миокарда в целом. Накоплен большой клинический опыт применения триметазидина при стабильной стенокардии у больных пожилого возраста, с дисфункцией левого желудочка и явлениями хронической сердечной недостаточности. Для улучшения приверженности лечению больных ИБС является создание ЛС с удобным режимом дозирования. Одним из таких препаратов является Депренорм ОД 70 мг – миокардиальный цитопротектор с собственной матрицей модифицированного высвобождения для однократного применения. Создание препаратов с удобным для пациента режимом дозирования позволит решить вопрос повышения приверженности пациентов к лечению и, как следствие, снижения частоты приступов стенокардии и улучшения качества жизни такой категории больных.
Ключевые слова: ишемическая болезнь сердца, стенокардия, прекондиционирование, цитопротекция, триметазидин, оригинальный препарат, дженерик, фармакотерапия.
Для цитирования: Сизова Ж.М. Фармакотерапевтические подходы к лечению стабильной стенокардии: трудные вопросы – простые решения. Медицинский совет. 2021;(4):34–40. doi: 10.21518/2079-701X-2021-4-34-40.
Конфликт интересов: автор заявляет об отсутствии конфликта интересов
Информация об авторе: Сизова Жанна Михайловна, д.м.н., профессор, заведующая кафедрой медико-социальной экспертизы, неотложной и поликлинической терапии, Первый Московский государственный медицинский университет имени И.М. Сеченова (Сеченовский Университет); 119991, Россия, Москва, ул. Трубецкая, д. 8, стр. 2; директор, Методический центр аккредитации специалистов, 117418, Россия, Москва, Нахимовский проспект, д. 49; sizova-klinfarma@mail.ru
Введение
Несмотря на возможности современной фармакотерапии и накопленный опыт по реваскуляризации миокарда, сердечно- сосудистые заболевания, в первую очередь ишемическая болезнь сердца (ИБС), являются основной причиной инвалидизации и смертности трудоспособного населения в экономически развитых странах [1].
Больные стабильной стенокардией, в т. ч. перенесшие инфаркт миокарда (ИМ), составляют самую многочисленную группу среди больных ИБС. Уровень ежегодной смертности таких пациентов, по данным различных регистров, составляет 2–3% [2]. Кроме того, качество жизни больных ИБС, как правило, находится на низком уровне со значительными ограничениями в повседневной жизни из-за возникающих приступов стенокардии. Это объясняет интерес практических врачей к вопросам тактики ведения таких пациентов и выбору оптимальных подходов к антиангинальной (противоишемической) терапии.
В основу выбора антиангинальной лекарственной терапии у больных со стабильным течением ИБС положен принцип доказательности (Рекомендации Европейского общества кардиологов (ESC) по диагностике и лечению хронических коронарных синдромов, 2019 г.) [2, 3].
Согласно современным клиническим рекомендациям [2], с целью уменьшения клинических проявлений стенокардии в клинической практике используют два ряда (линии) антиангинальных лекарственных средств (ЛС). К препаратам первой линии относят бета-адреноблокаторы и антагонисты кальция, к препаратам второй линии (препараты резерва) – длительно действующие нитросодержащие препараты, никорандил, ивабрадин, триметазидин и ранолазин. Важно отметить, что такое деление ЛС является достаточно условным в связи отсутствием обоснованных сравнительных данных о преимуществах того или иного препарата. Влияние на продолжительность жизни больных ИБС доказано только у бета-адреноблокаторов и верапамила, к применению которых существует ряд противопоказаний [4].
Зарубежными авторами предложен более свободный алгоритм выбора ЛС и их комбинаций у больных стабильной стенокардией, в основу которого положен принцип индивидуального подхода с учетом гемодинамических показателей, наличия сопутствующих заболеваний и переносимости ЛС. Такой алгоритм получил название «бриллиантовый подход», было достигнуто согласованное мнение экспертов о преимуществах такого подхода при выборе тактики лечения пациента со стабильным течением ИБС по сравнению с клиническими рекомендациями.
Более того, особенности патогенеза ИБС в виде повышенной потребности миокарда в кислороде в результате увеличения частоты сердечных сокращений (ЧСС), повышения пред- и постнагрузки на сердце диктуют необходимость назначения ритмоурежающих ЛС – бета-адреноблокаторов, блокаторов кальциевых каналов, ивабрадина или их комбинаций, а также нитросодержащих препаратов; с целью увеличения коронарного кровотока – никорандил, триметазидин, ранолазин [5, 6].
Современные возможности фармакотерапии стабильной стенокардии
Нами была изучена частота назначения врачами первичного звена в реальной клинической практике различных антиангинальных ЛС по данным анализа записей 1 206 амбулаторных медицинских карт больных стабильной ИБС (652 мужчины и 556 женщин в возрасте от 48 до 69 лет, средний возраст – 58,9 ± 7,7 лет), наблюдавшихся в городской поликлинике №2 ДЗМ.
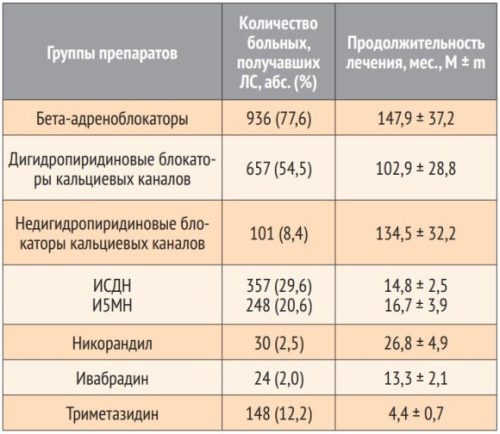
Результаты анализа показали, что бета-адреноблокаторы назначались 77,6% амбулаторным больным ИБС; дигидропиридиновые блокаторы кальциевых каналов – 54,5%; недигидропиридиновые блокаторы кальциевых каналов – 8,4%; препараты изосорбида-д инитрата (ИСДН) – 29,6%; изосорбида-5 мононитрата (И5МН) – 20,6%; никорандил – 2,5%; ивабрадин – 2,0%; триметазидин – 12,2% больным ИБС (табл.).
Полученные данные свидетельствуют, что традиционно для купирования и уменьшения частоты приступов стенокардии в амбулаторно-поликлинической практике используются нитраты. Однако при назначении данной группы препаратов нередко наблюдаются нежелательные лекарственные реакции, в частности появление головной боли. Кроме того, многочисленные исследования, в т. ч. результаты диссертационного исследования (Н.В. Козлова), подтверждают частое развитие толерантности к нитро- содержащим препаратам при их длительном применении в виде снижения клинического эффекта, подтверждаемое снижением функции эндотелия в виде уменьшения прироста диаметра плечевой артерии в условиях пробы с реактивной гиперемией.
Одной из возможных причин развития толерантности к нитратам является активация процессов свободнорадикального окисления, приводящая к снижению активности антиоксидантных ферментов.
Использование препаратов гемодинамического действия (бета-адреноблокаторы, блокаторы кальциевых каналов) не всегда эффективно контролируют симптомы стенокардии даже при применении их в комбинации [7]. Поскольку приступы стенокардии возникают вследствие повышения потребности миокарда в кислороде, терапия, направленная на снижение ЧСС и АД, является патогенетически обоснованной.
Важно отметить, что бета-адреноблокаторы не только улучшают качество жизни больных стабильной ИБС вследствие снижения частоты приступов стенокардии, но и способны улучшить прогноз после перенесенного ИМ (в течение первого года) и присоединения явлений хронической сердечной недостаточности. Дигидро- пиридиновые блокаторы кальциевых каналов по антиангинальной эффективности сопоставимы с бета-адреноблокаторами, действуют преимущественно на тонус артериол, улучшают кровоток и доставку кислорода к ишемизированной зоне миокарда и рекомендованы при сочетании стабильной стенокардии и АГ [3]. Недигидропиридиновые блокаторы кальциевых каналов по ритмоурежающему действию схожи с бета-адреноблокаторами и могут быть использованы у больных ИБС при непереносимости бета-адреноблокаторов или наличии противопоказаний к ним.
К особой категории пациентов с ИБС, в лечении которых практические врачи испытывают трудности, относятся больные с гипотонией, бронхиальной астмой и перемежающейся хромотой. В таких случаях следует использовать блокатор f-каналов ивабрадин, не оказывающий влияния на показатели центральной гемодинамики [8]. Механизм отрицательного хронотропного действия ивабрадина обусловлен ингибированием f-каналов, которые находятся в основном в пейсмекерных клетках синусного узла, что приводит к уменьшению угла наклона спонтанной диастолической деполяризации, увеличению диастолы. Очередной потенциал действия возникает позднее, и тем самым уменьшается ЧСС и, как следствие, снижается потребность миокарда в кислороде.
В последние годы большой интерес вызывают препараты модуляторов (активаторов) калиевых каналов, представителем которых является никорандил. Результаты клинических исследований зарубежных и отечественных авторов [9, 10] свидетельствуют о высокой антиангинальной эффективности препарата. В отличие от бета-адреноблокаторов и блокаторов кальциевых каналов никорандил практически не влияет на ЧСС, сердечную проводимость и сократительную способность миокарда; в отличие от антиангинальных ЛС нитратной структуры к действию никорандила не отмечено развития толерантности. Препарат целесообразно назначать больным ИБС, которые имеют противопоказания, плохо переносят или имеют симптомы стенокардии, недостаточно контролируемые бета-адреноблокаторами, блокаторами кальциевых каналов и нитратами.
Таблица. Частота назначения врачами первичного звена антиангинальных ЛС в условиях городской поликлиники
Миокардиальные цитопротекторы в лечении стабильной стенокардии
Доказано, что ИБС относится к многофакторным заболеваниям с многочисленными звеньями патогенеза: вазоспазм, нарушение функции эндотелия, воспаление, микроциркуляторная дисфункция и т. д. Кроме того, в условиях ишемии миокарда развивается дефицит аденозинтрифосфорной кислоты (АТФ). Использование ЛС первой линии (бета-адреноблокаторы и блокаторы кальциевых каналов), а также препараты резерва (нитраты, ивабрадин, никорандил) не всегда эффективно контролируют симптомы заболевания даже при применении их в комбинации. По-видимому, это связано с тем, что возможности антиангинальной терапии ограничены наличием других адаптационных процессов, оказывающих существенное влияние на кардиомиоциты и миокард в целом, что диктует необходимость дальнейшего совершенствования медикаментозного воздействия на ишемизированный миокард с учетом формирования новых представлений о нарушениях, происходящих в метаболизме кардиомиоцитов при гипоксии.
Известно, что ишемия миокарда на клеточном уровне характеризуется снижением окисления глюкозы и повышением использования свободных жирных кислот (СЖК).
Резкий дисбаланс между окислением глюкозы и использованием жирных кислот, а также повышенная концентрация жирных кислот в ишемизированной зоне являются основными факторами риска реперфузионного повреждения и дисфункции миокарда, развития опасных нарушений ритма сердца [11]. Изучение биохимических процессов, протекающих в ишемизированном миокарде, привело к созданию препаратов, способных воздействовать на определенные звенья патогенеза ишемии.
К препаратам, блокирующим окисление жирных кислот, относится широко используемый в повседневной клинической практике триметазидин [12]. Антиангинальное и антиишемическое действие триметазидина [9–11] заключается в том, что под его воздействием в условиях ишемии нормализуется энергетический метаболизм клеток путем оптимизации использования кислорода миокардом за счет усиления аэробного гликолиза и уменьшения интенсивности окисления СЖК [12]. Это позволяет сердечной мышце оптимально использовать недостаточное в условиях ишемии количество кислорода и продолжать синтез АТФ, необходимый для нормального функционирования кардиомиоцитов. Данный механизм препятствует возникновению клеточного ацидоза и накоплению недоокисленных жирных кислот, лактата и кислых эквивалентов, которые и являются в определенной степени причиной возникновения ангинозной боли [13].
Таким образом, предотвращение приступа стенокардии происходит при использовании триметазидина на начальных этапах ишемии – на уровне нарушения метаболизма, что не позволяет развиваться более поздним осложнениям: нарушениям сократительной функции кардиомиоцитов и миокарда в целом.
Триметазидин – первый препарат из группы миокардиальных цитопротекторов, рекомендованный экспертами Европейского общества кардиологов (ЕОК), Американской коллегии кардиологов и Американской ассоциации сердца (АКК/ААС), а также экспертами Российского кардиологического общества (РКО) в качестве антиангинального средства для лечения больных стабильной стенокардией [4, 14–16]. Согласно Российским рекомендациям по диагностике и лечению стабильной стенокардии 2020 г., триметазидин показан к назначению на любом этапе терапии стабильной ИБС для усиления антиангинальной эффективности гемодинамически активных препаратов (бета-адреноблокаторов, антагонистов кальция или нитратов), а также в качестве альтернативы при их непереносимости или противопоказаниях к их применению [2].
Триметазидин может использоваться как в монотерапии, так и в комбинации с антиангинальными препаратами первой линии [17], в т. ч. в случаях, когда лимитировано назначение традиционных ЛС с гемодинамическим действием: при брадикардии, гипотонии, нарушениях атриовентрикулярной проводимости, а также при гемодинамически значимых стенозах клапанного аппарата сердца, бронхиальной астме, периферическом атеросклерозе и т. д. К настоящему времени накоплен большой клинический опыт применения триметазидина при стабильной стенокардии, в т. ч. у больных пожилого возраста, дисфункцией левого желудочка и явлениями хронической сердечной недостаточности [18, 19].
Изначально использовали традиционную лекарственную форму триметазидина 20 мг для трехкратного применения в сутки, позже была создана лекарственная форма с замедленным контролируемым высвобождением действующего вещества – триметазидин MB 35 мг (модифицированное высвобождение). Результаты отечественного исследования (Т.А. Федорова и соавт.) показали, что длительное применение (до 6 мес.) в качестве цитопротективной терапии триметазидина MB 35 мг и в комбинации его с селективным бета-адреноблокатором бисопрололом у больных стабильной ИБС с сопутствующей ХСН улучшает клиническое течение заболевания, при этом снижение ФК стенокардии на 2-й ступени удалось достигнуть у четверти больных на фоне сочетанной терапии.
Нередко перед практическим врачом стоит нелегкая задача по выбору ЛС при долгосрочной терапии стабильной ИБС. Что выбрать: оригинальный препарат или дженерик? И если дженерик (экономическая целесообразность заставляет врача воспользоваться в первую очередь именно дженериком), то какой именно, будет ли лечение дженерическим препаратом столь же эффективным и безопасным, как лечение оригинальным препаратом? Результаты ряда клинических исследований свидетельствуют о том, что не все дженерические препараты являются эквивалентными копиями оригинальных ЛС [20].
Оригинальным препаратом триметазидина, зарегистрированным в России, является препарат Предуктал® МВ (лаборатория «Сервье», Франция), на российском аптечном рынке представлен целый ряд дженерических препаратов триметазидина: Депренорм® МВ, Тримектал, Президин, Антистен® МВ и др. Одним из дженериков оригинального препарата триметазидин является препарат с доказанной терапевтической эквивалентностью Депренорм® МВ (производства компании ЗАО «Канонфарма продакшн», Россия) для применения у больных стабильной ИБС.
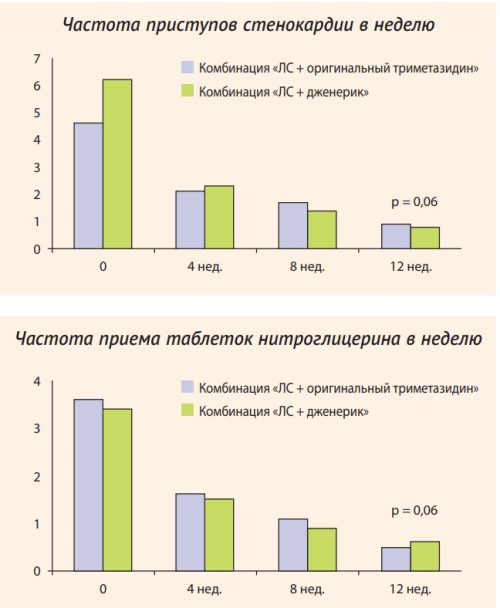
Российское исследование «Кардиоканон» [21] по сравнительной оценке эффективности и безопасности комбинированной терапии у больных стенокардией напряжения II–III ФК, включающей оригинальные ЛС и дженерики, доказало (помимо уже имеющихся данных о биоэквивалентности ЛС) клиническую эквивалентность препарата Депренорм® МВ оригинальному триметазидину, что позволяет рассчитывать на равнозначный клинический эффект не только для профилактики приступов стенокардии (рис.), но и для вторичной профилактики осложнений у больных ИБС.
Кроме того, серьезной проблемой долгосрочной терапии больных стабильной ИБС является низкая приверженность пациентов лечению [22]. По данным анкетирования 776 больных, наблюдавшихся в КД №2 г. Москвы, проведенного нами в 2016 г., 51,8% больных стабильной ИБС были привержены рекомендациям и медикаментоз ному лечению; 35,5% пациентов лекарственные препараты принимали нерегулярно; 12,7% – принимали ЛС только при необходимости (приступах стенокардии). Детальный анализ причин неудовлетворительной приверженности лечению пациентов показал, что к наиболее частым причинам относятся высокая стоимость ЛС (26,2%), большое количество таблеток и прием их несколько раз в сутки (21,9%), нежелательные лекарственные реакции (10,7%), забывчивость (14,9%), уровень образования (5,8%) и др. Наши данные подтверждают результаты исследований зарубежных авторов (R. Mathews et al.) по приверженности лечению больных стабильной стенокардией: через полтора месяца треть пациентов не соблюдали режим лекарственной терапии, через два года половина пациентов прекратили прием бета- адреноблокаторов [23].
Рисунок. Сравнительная оценка эффективности оригинального и дженерического прапаратов триметазидина у больных стабильной стенокардией
Одним из путей улучшения приверженности лечению больных стабильной стенокардией является создание ЛС с удобным режимом дозирования. Одним из таких препаратов является Депренорм ОД 70 мг, который первым в России был зарегистрирован как миокардиальный цитопротектор с собственной матрицей модифицированного высвобождения для однократного применения и отмечен премией «Социально значимый препарат».
Инновационная форма препарата Депренорм ОД 70 мг с приемом 1 раз в сутки обеспечивает своевременную антиангинальную эффективность на протяжении 24 ч. Создание препаратов с удобным для пациента режимом дозирования позволяет решить вопрос повышения приверженности лечению и, как следствие, приводит к снижению частоты приступов стенокардии и улучшению качества жизни такой категории больных. Они могут применяться в качестве долгосрочной терапии ИБС для профилактики приступов стенокардии.
Заключение
Таким образом, с учетом современных знаний о биохимических процессах, протекающих в ишемизированном миокарде, в основе которых лежат метаболические нарушения, целесообразно включение миокардиального цитопротектора триметазидина в комплексную терапию стабильных форм ИБС. Препаратом выбора у такой категории больных может быть отечественный препарат Депренорм® ОД 70 мг с удобным для пациента режимом дозирования, доказавший высокую антиангинальную и антиишемическую эффективность и позволяющий значительно повысить приверженность лечению.
